Nykyisessä taloustilanteessa olisi äärettömän mielenkiintoista kuulla, millaiset ovat Faronin suunnitelmat. Kuten Faron on itsekin viestinyt, tulevat Faasin 2 tutkimukset maksavat kymmeniä miljoonia, eikä Faronilla sitä rahaa ole. Omin voimin jatkaminen vaikuttaa siten yhä epätodennäköisemmältä.
Redeyellä on huomenna Life Science Day
https://www.redeye.se/events/850947/redeye-life-science-day#schedule
jossa taas Faronkin mukana klo 9.40. Video tuli jo. Se pitäisi näkyä kirjautumatta, mutta ilmainen rekisteröityminen vaadittaneen itse tapahtumaan, jonne voi kirjoittaa jo kysymyksiäkin Faronille, niihin on joskus jopa vastattu!
Luettelee PD-(L)1 markkinoijat eli potentiaaliset kauppakumppanit
MSD, BMS, Pfizer, Novartis, Roche, Merck, Regeneron, Sanofi. Aiemmassa viestissä taisin luetella 2, joilla kaikki BEXCOMBOn käyttöaiheet. BEXCOMBOa ja MATINSia käsittelevät slidet näkyi jo lokakuun presiksessä, jonka @marie linkkasi 19.10.22
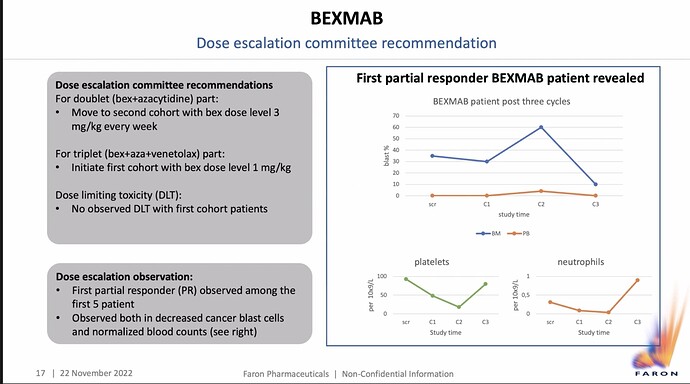
BEXMABista pari uutta? slidea. Toisessa Markku mainitsee, blastit vähenevät (veressä? luuytimessä?) että luuydinkin olisi toipumassa, mutta olisiko kyse siitä, että kun atsasitidiinissä on viikon hoito ja 3 viikkoa lepoa, niin on luonnollista, että atsan haittavaikutus hiipuu. Muuten, quite huge if true. Tosin vasta osittainen vaste ja niitä 1, kun n=5. Markku kyllä totesi potilaan ollut rekrytty jo kesäkuussa ja 3 sykliä takana, joten tarkoittaako 3 atsan sykliä, jotka siis 4 viikkoa kukin eikä Bexin 1 viikon sykliä, se tekisi järkeä ja hugehko, kunhan vielä muutamat samanlaiset kasassa, niin sitten huge.
BEXMABista. Sanotaan tuo selvällä suomenkielellä CT:ssä, että 28-day cycle. Kesäkuussa siis aloitettu ja tuo pisimpään tutkimuksessa ollut potilas on saanut 3 sykliä lääkitystä ja viimeisimmät koetulokset ovat siten syyskuulta. Tässä vaiheessa mentiin vasta pienimmällä Bex-annoksella eli 1 mg/kg. Näitä potilaita n=5. Lokakuun lopussa oli lupa nostaa annos 3 mg/kg ja taas odotetaan 3 kk eli helmikuuhun 2023. Kymmenkertainen annos tulee Markun mukaan ehkä, muttei ole päätetty. Jos, niin sitten maalis-huhtikuussa ja sen tulokset luetaan kesällä? 30 mg/kg taitaa olla sliden mukaan kuopattu, mikä nopeuttaisi siten usealla kuukaudella edistymistä faasi 2:een, jossa potilaita enemmän, kunhan tuo optimaalinen Bex-annos on määritelty. MATINSissa suurin hyöty nähtiin jo 1 mg/kg:lla.
Nyt on myös lupa aloittaa tuoreen akuutin leukemian hoito Bexillä osana kolmoislääkitystä. Markun mukaan jo ”on going”. Tosin vain leukemiat niillä potilailla, jotka eivät rankempaa kemoterapiaa kestä.
Veressä kiertävän Clever-1-proteiinin määrä on laskenut merkittävästi Bexillä hoidetuilla BEXMABissa. MATINSiin liittyvän tutkimuksen perusteella Clever-1 on todettu T-solujen estäjäksi ja siten se toimisi immuniteetin heikentäjänä.
Tuossa Markun kuvassa edellä on luuytimessä (BM) tutkimukseenottovaiheessa 35 % blasteja eli epäkypsiä verisoluja. Määritelmän mukaan kyseessä on jo leukemia, kun blasteja on yli 19 % soluista. Näin ollen potilas kuuluu tuohon r/r AML-ryhmään, jossa leukemia on uusinut (relapsed) tai blasteja on jäänyt hoidosta huolimatta (refractory). Tuo on se huonoennusteisin tauti. Kyseessä lienee iäkäs tai monisairas immeinen, joka ei kovia sytostaatteja kestä eikä kelpaa parantavaan hoitoon eli luuydinsiirtoon. Jos aiempi hoito on ollut atsasitidiini ja sillä ja Bexillä jatketaan, tulokset ovat vaikuttavia. Jos hoito on ollut jotakin muuta, voi pelkkä atsa selittää hoitotulosta. Sen kun tietäisi ja sen, miten veren (PB) blastit ovat käyttäytyneet ennen seulontaa, tuossa kuvassa ne ovat nollan tienoilla.
Ai miten niin kiinnostavaa? Nämä kuukaudet näyttävät, mikä kyky Bexillä alustavasti on verisyövissä ja nopeammalla aikataululla kuin kiinteissä ja jos näyttää lupaavalta, voi Big Pharma käydä kiinni kuin sika limppuun eli tässä tapauksessa Faroniin. Ja se olisi tod näk eri sika kuin BEXCOMBOssa/MATINSissa.
Tässä kokeessa syöpäsolut itsessään yliekspressoivat Clever-1:tä, joten optimaalinen Bex määrä Clever-1:n toiminnan blokkaamiseen voi myös olla suurempi kuin Matinsissa. Oletettavasti myös liukoisen Clever-1:n määrä voi olla suurempi näissä syövissä ja sen blokkaamiseen taitaa kulua myös enemmän vasta-ainetta. Käsittääkseni liukoinen Clever-1 oli yksi tekijä mikä viivytti Matinsin tuloksia Bexin annostelua haettaessa.
Edit:
Tuossa @Mestarihiihtaja:n aiemmin jakamassa MLF:n haastattelussa about 3 min kohdilla mainitaan, että tälle ensimmäiselle Bexmab potilaalle on annettu ensivaiheen hoitona Azaa.
Hyvät huomiot!
M-L tosiaan näin todistaa, että oli atsalla ennen Bexiä ja tuon jälkeen tuli nuo hoitovasteet. Näin ollen, Bexin lisäys olisi selittävä tekijä.
Jos seuraat jokaista kanavaa ja kaikkia työntekijöitä, voit saada näköjään informaatioetua. Tai sitten luet Kauppalehdestä, mitä on tapahtunut ja miten kurssi oli reagoinut.
Syöpäsäätiö avittaa makrofagitutkimusta: Dosentti Maija Hollmén (Turun yliopisto) (siis meidän Maija) ja tutkimusryhmä, 140 000 €, Advancing macrophage-directed therapies in cancer. 2-vuotiseen tutkimustyöhön, 2-year research grant.
Tuolla voisi esim. saada apurahalla maksettuja väitöskirjatutkijoita 2 kpl ja tarvikkeita pariksi vuodeksi.
Suurempi paukku eli
Kolmivuotinen 450 000 euron suurapuraha myönnettiin professori Satu Mustjoen (Helsingin yliopisto) tutkimushankkeelle ”Kohti yksilöllisiä immunologisia hoitoja verisyövissä”. Tutkimuksella etsitään uusia immunologisia hoitoja huonoennusteisille verisyöville. Tällaiset leukemiat eivät ole hoidettavissa uusillakaan immunologisilla hoitomuodoilla, vaan väistävät elimistön puolustusjärjestelmät. Mustjoen tutkimusryhmä yhteistyötahoineen pyrkii selvittämään mekanismeja, joilla pahanlaatuisiksi muuttuneet verisolut väistävät immuunipuolustuksen ja muuttuvat hoidoille vastustuskykyisiksi. Hankkeessa etsitään myös uusia lääkeyhdistelmiä, joita immuunihoitoihin yhdistämällä voidaan tuhota syöpäsoluja. Tavoitteena on lisätä ymmärrystä syövän immunologiasta molekyylitasolla ja kehittää yksilöllistettyjä immuunihoitoja verisyöpiin.
Mustjoki on julkaissut mm. T-soluista ja syövästä juttua, jossa myös makrofagit seikkailevat eli Faronin BEXMAB-touhuja liippaa tämäkin.
Tähän vielä liittyen, Faron on twiitannut eilen tällaisesta tapahtumasta, johon ovat osallistumassa. https://twitter.com/FaronPharm/status/1595727413832519681?cxt=HHwWgsC4vZvolKUsAAAA
Tuolta vois olla mahdollista saada lisää rahoitusta näiden kokeiden eteenpäin viemiselle.
Tässä ei taida olla mitään uutta, mutta Faron mainittu.
Markun tänään julkaistu haastattelu:
Nosto tosta markun haastattelusta. Ei mitään uutta, näinhän hän aina vastaa tähän kysymykseen, mutta toi loppuosa on mielenkiintoista pientä hypen nostoa ![]()
The partnering discussions are ongoing, but while doing those we want build additional data. And for example the bexmab next readout what then ever we get (from) it, would be very exciting, especially if we start to see complete responders or additional partial responders. And all that data builds that trust for the molecule and mode of action where we dont have any competitors.
Aiemmin tossa jos ymmärsin oikein niin vahvisti että se partial responderi bexmabissa oli ensimmäinen, josta oli responssi tarjolla, mitä tossa aiemmin veikkailtiinkin, joten todella mielenkiintoista odotella ekaa readouttia.
“Have the partnering candidates asked for more data?”
Obviously they have been interested in dosing and that box we can soon tick and get that validated with the FDA.
Then the selection of the cancer types, we have been able to enrich them, or we have biomarkers to help that.
Bexmab alone is very interesting for those who are dealing with the hematological malignancies (and obisoly that group is limited).
Lets put it this way, every meeting we are going to we run out of partnering time.
Hyviä signaaleja tulee, kysymys on edelleen että kuinka pitkään he vetävät tätä omillaan ja että millaisen lisensointidiilin tekevät.
MATINS tutkimussuunnitelmaa on päivitetty. Ilmeisestikin juuri FDA-keskustelua ajatellen. Kuvassa vihreällä.
—————————————————————————————
Pohdintaa:
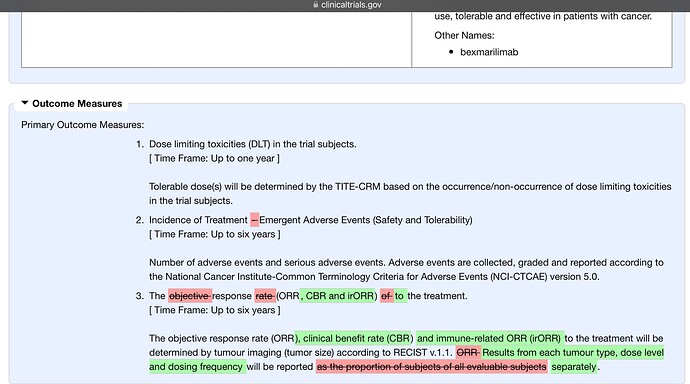
- ORR = the proportion of patients with a complete response or partial response to treatment according to Response Evaluation Criteria in Solid Tumors (RECIST) (RECISTissä valitaan taulukon mukaisesti seurattavat pesäkkeet. Tätä ORR on kritisoitu, että se ei erottele täydellistä ja osittaista vastetta ja unohtaa seurattavien pesäkkeiden stabiloitumisen)
- Clinical benefit rate (CBR) is defined as the percentage of advanced cancer patients who achieve complete response, partial response, or at least six months of stable disease as a result of therapy.
The FDA now recognizes the clinical benefit of both DFS and PFS and allows for their use as primary end-points in trials seeking regulatory approval [24]. Moreover, there is growing evidence for using PFS and DFS as primary clinical endpoints in special circumstances as outlined above. In a recent announcement by the FDA (regulation 21CFR813, subpart H), PFS and other surrogate endpoints can be used in cases to accelerate approval of drugs targeting serious or life-threatening diseases [53].
- Uutena nyt tuo immune-related ORR. The immune-related response criteria, first published in 2009,[1] arose out of observations that immuno-oncology drugs would fail in clinical trials that measured responses using the WHO or RECIST Criteria, because these criteria could not account for the time gap in many patients between initial treatment and the apparent action of the immune system to reduce the tumor burden.
The newest alternatives of RECIST are immune-specific response criteria for checkpoint inhibitors. Metabolic response assessments using positron emission tomography PET or PET/computed tomography may reflect the viability of cancer cells or functional changes that occur after anticancer treatments.
(PET on käytössä rutiinisti nykyisten sytostaattienkin aikana esim. lymfooman tautiaktiivisuuden mittarina ennen ja hoidon jälkeen.)
Lontoon puolella johtavat Markkulogit ovat yrittäneet ymmärtää, mitä Markku tarkoitti tuolla lauseella. Tässä joitakin:
- Still not sure I got it right - but its a positive statement - so perhaps he means that every meeting has been run ( ie built around ) partnering times (ie when can we partner with you )
- Whatever marku said it sounds like a riddle!
Lol - I’m quite sure that he tried to say ”Every meeting gets us closer to partnering”.
- I would guess every meeting they go is a buyout or a M&A negotiation so leaving less and less opportunities for partnering?
- The buyout or M&A scenario may even have run out of time also , if Faron decide to try and market it themselves .
Itse halusin aluksi ymmärtää lausetta niin, että jokaisessa partnerointikeskustelussa aika loppuu kesken. Keskustelu esim tyyliin:
-”Saat markan”
-”Ei riitä, sata miljoonaa alkuun”
-”Markka viiskyt”
-jne
Tuo aiemmin linkattu väitöskirjatyö saattaa liittyä juuri tähän immune related ORR kysymykseen. Siinä kirjassa zirkonium merkattua Bexiä oli testattu PET merkkiaineena munuaisvaurioihin jäniksillä, mutta ihmiskokeiden tuloksia tuskin julkaistaan ennenkuin ne on patentoitu. Tuolla menetelmällä voisi kai teoriassa seurata Clever-1 positiivisten makrofagien määrää syöpäpesäkkeissä ja päätellä siitä jotain hoidon vaikutuksista.
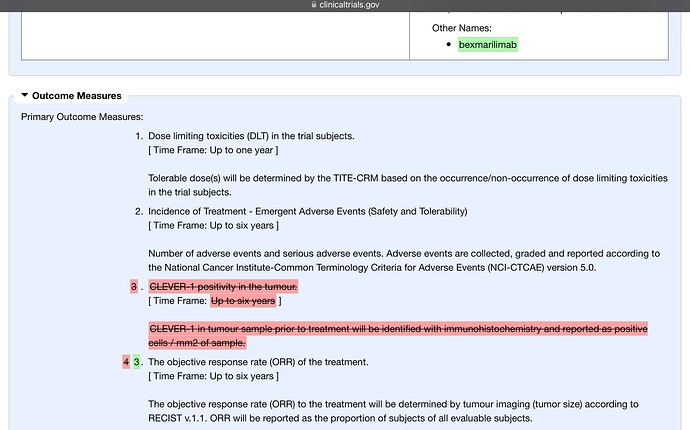
MATINSin suunnitelmasta nimenomaan poistettiin 14.7.22 kasvaimen CLEVER-positiivisuus primaari outcomesta. Johtuuko se siitä, että kyse olisi ollut kajoavasta näytteenotosta ja se kävi mahdottomaksi toteuttaa seurannassa? Tähän en Faronin kommenttia ole nähnyt, miksi näin tehtiin. Nytkö olisi näkyvissä kajoamaton tapa tehdä tuo? Ympäri mennään, yhteen tullaan? Nerokasta, jos näin olisi.
Esim. lymfooman aktiivisuutta seurataan fluorileimatulla sokerilla. Kuvastaa siis pesäkkeen aineenvaihdunnan aktiivisuutta. Sammunut hyvä, aktiivinen paha.
CLEVER-1 proteiinin esiintymistä voidaan nyt seurata zirkoniumleimatulla Bexillä. Aluksi aktiivisuus pahasta ja jos hiljenee, niin hyvästä? Sama koskee kai myös BEXMABia, luuytimen kuvantaminen. Luuytimestä tosin on helpompi saada solunäyte kuin sisuskaluista.
Faronin nousuvauhti on kyllä ollut viime päivinä käsittämätön.
Mieleen tulee väkisin mahdollisuus, että neuvotteluista on päässyt jotain konkreettista tietoa markkinoille ja joku tietää enemmän kuin muut.
Toki Faronin arvo voi heitellä rajusti ja siitä voi olla hyvin erilaisia käsityksiä, mutta silti viime päivien rakettimainen kurssinousu ja korkeat volyymit antavat, jonkin verran syytä epäilylle, että joku tietää jotain mitä muut ei.
Toki on mahdollista, että Varma on ostanut osakkeita isommin tai joku muu iso toimija ilman suurempaa dramatiikkaa, mutta tämäkin on ehkä hieman outoa kun äskettäin ankkurit pääsivät ostamaan osakkeita 1,85€ tuoreessa annissa.
Huomenna tulee julki uusi suurten omistajien lista, joka voi selventää asiaa.
Mielestäni on kummallisempaa, että Faronin hinta oli ylipäätään päässyt lipumaan niin alas kuin missä se noin kuukausi sitten oli. Tämän vuoden aikana Bexin tarina on kuitenkin vahvistunut huomattavasti esimerkiksi biomarkkereiden ja alustavan tehokkuusdatan perusteilla, jotka ennustavat parempia mahdollisuuksia seuraaviin kokeisiin. Tietenkin tuossa on ollut Traumakinen koronaprojektin lopetus, mutta en näe, että se olisi ollut niin suuri tekijä. Käytännössähän tämä lappu on mennyt vuoden mittaan hyvin pienellä vaihdolla alaspäin ja enimmäkseen GSAG:n myymänä. Liekö sitten ollut epävarmuutta rahoitukseta tai jotain vastaavaa taustalla.
Näiden tulosta tekemättömien lääkefirmojen arvostus lienee kai aina aika hankala kysymys, mutta kannattanee verrata Faronin nykyistä markkina-arvoa esimerkiksi verrokkeihin. Tästä löytyy hyvä kuva tuolta Inderesin laajasta raportista. Jos markkina uudelleen hinnoitelee Faronia nyt esimerkisi Matinsin siirtymän mukaan faasista I/II faasiin II/III, niin tuossakin ryhmässä on vielä matkaa verrokkien mediaaniin (siis faasin III firmoilla). Faasin II kokeet taitavat olla se kaikista vaikein kohta missä historiallisesti noin 75% kliinisen vaiheen yrityksistä epäonnistuu.
Olen samaa mieltä, mutta on silti asia on mielestäni hieman kummallinen, koska kaikki mitä nyt on tiedossa, on ollut tiedossa myös lokakuun lopulla ja rahoitus oli silloin jo kerätty. Lokakuun lopussa hinta oli alle 2€ ja nyt 3,5€. Ainakin teorian mukaan markkinahinnoittelu perustuu yleisesti tarjolla olevaan informaatioon ja informaatio pyritään hinnoittelemaan kursseihin hyvin nopeasti.
Tämän valossa uuden informaation ei pitäisi perustella nousua.
En ole sitä mieltä ettei nykyinen hinta olisi perusteltu. Mutta mielestäni on mahdollista, että tietoa on lipsahtanut markkinoille neuvotteluista tai jostain muusta. Onhan näitä tapauksia aina välillä, joissa markkinoille tulee “huhuja” esim. Fortumin Uniper-kauppa, jossa markkina alkaa hinnoittelemaan tietoa, mitä ei ole kerrottu julkisuuteen.
Faron Appoints Maija Hollmén, Ph.D., as Chief Scientific Officer
Company announcement, December 1, 2022, at 02:00 AM (EST) / 07:00 AM (GMT) / 09:00 AM (EET)
TURKU, FINLAND / BOSTON, MA- Faron Pharmaceuticals Oy (AIM: FARN, First North: FARON), a clinical stage biopharmaceutical company focused on tackling difficult-to-treat cancers and inflammation via precision macrophage immunotherapy, today announces the appointment of Faron Co-founder Maija Hollmén, Ph.D., as Chief Scientific Officer.
In her new role, Dr. Hollmén will oversee preclinical and support clinical development for Faron. Her priority will be the further development of bexmarilimab, Faron’s wholly owned, novel precision cancer immunotherapy candidate. Bexmarilimab is currently being evaluated for safety and efficacy in a Phase I/II clinical trial, in combination with standard of care (SoC), in aggressive hematological malignancies including acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS). The potential therapy has already achieved a strong safety and overall survival benefit profile in the Phase I/II MATINS trial as a monotherapy in late-stage solid tumors.
“Dr. Hollmén is the world-leading expert on CLEVER-1 biology and Clever-1-expressing tumor-associated macrophages,” said Marie-Louise Fjällskog, Chief Medical Officer of Faron. “Her support is essential to bexmarilimab’s development. Faron is pleased to have her on board in the Chief Scientific Officer role to bring her knowledge of the target molecule and develop it further.”
Dr. Hollmén is an Adjunct Professor of Tumor Immunology on the Faculty of Medicine at the University of Turku in Finland, as well as a Principal Investigator. Dr. Hollmén earned both her PhD and MSc degrees from the University of Turku.
“I am excited to join the team at Faron as we work to advance bexmarilimab’s development for the treatment of advanced cancers,” said Dr. Hollmén. “I am inspired by the possibility to make a difference for patients who have no other options and to be part of the pioneering work Faron is currently doing in developing next-generation immunotherapies.”
Dr. Hollmén’s post-doctoral studies were conducted at ETH Zurich alongside Professor Michael Detmar, focusing on tumor immunology and how cancer cells educate macrophages to support tumor growth. Dr. Hollmén returned to Turku and formed her own laboratory to develop strategies to resolve immunosuppressive cells and pathways and during this time, concentrated working on CLEVER-1.
Suurinpiirtein sama Suomeksi
Joo ite ajattelin kanssa että jos vaihdetaan ORR → irORR, niin olisko mahdollista että responsseissa on tullut jotain sellaista esille jota Recist-kriteeristö ei luokittele oikein.
Esim Recistin mukaan jos läpimitta kasvaa yli 20% se on aina PD, vaikka tuumori stabilisoituisi tai pienenisi myöhemmin. Immunoterapiassa tätä kutsutaan pseudoprogressioksi, jossa aluksi näyttää siltä että kasvain kasvaa, mutta alkaa sitten pienentyä. Tällöin Recist 1.1 kriteeristöllä ei tulkittaisi tälläistä potilasta stable diseaseksi, vaikka se potilas olisikin yli sitten myöheemin tarpeeksi pitkään vakaa.
Toi CBR on varmasti lisätty tonne, koska niin harva oli partial response ja suurin osa oli vaan stable disease, joten ORR tai edes iORR ei tee oikeutusta tälle hoidolle. Eli valmistaudutaan esittelemään data FDA:lle