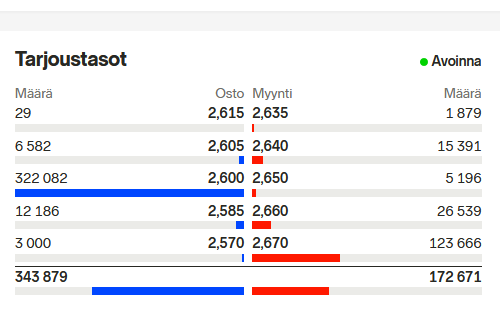
Yllä lainattu pätkä nyt aivan varmasti väärää tietoa: https://arocell.com/mfn_news/arocell-and-fda-has-had-a-pre-submission-meeting-for-the-510-k-clearance-of-arocell-tk-210-elisa/
-A person may submit a De Novo request after submitting a 510(k) and receiving a not substantially equivalent (NSE) determination.
-A person may also submit a De Novo request without first submitting a 510(k), if the person determines that there is no legally marketed device upon which to base a determination of substantial equivalence; that is, the company does not have to wait for FDA to issue an NSE.
Arocellin tapauksessa siis edettiin nyt tuota ensimmäistä eli pitkää reittiä pitkin ja suoritettiin ensiksi 510k hakemus, jossa Arocellin tuotteelle ei sitten löytynyt predikaattia (vastaavanlaista hyväksyttyä tuotetta) ja nyt uudessa uutisessa nostettiin esille mahdolliseen DeNovo - vaiheeseen siirtyminen. Tämä DeNovo - kuten nimi viittaa - tarkoittaa siis täysin uudenlaista tuotetta, jota ei voi rinnastaa mihinkään jo olemassa olevaan tuotteeseen. FDA:n sivuilta löysin tällaisen mielenkiintoisen tekstinpätkän:
“3.2 Submitting a De Novo Request for FDA Review
This guidance describes two mechanisms for interacting with FDA regarding a device for
which De Novo classification may be appropriate:
• Pre-Submission (Pre-Sub). A Pre-Sub is not required in order to obtain FDA
review of a De Novo request, but it is a useful way for requesters to obtain early
feedback from FDA. A Pre-Sub allows FDA to provide feedback on whether a
device may be eligible for the De Novo classification process, including whether
a potential predicate device exists, and/or to advise you on the documentation
needed in a subsequent De Novo request.”
Ainakin tuossa De Novo Pre-Subissa pyritään selvittämään onko tuote ylipäätänsä kelvollinen De Novo hakemuksen piiriin vai onko mahdollisesti predikaattilaite jo olemassa, jolloin voitaisiin siis tehdä hieman nopeampi 510k hakemus. Luulisi tämän myös olevan esillä tuossa 510k Pre-Subissa, jonka Arocell suoritti.
Tuntuu siis aivan käsittämättömältä että yli 14kk 510k hakemuksen jättämisen jälkeen saamme lukea tällaista: “The reason why it hasn’t been possible to find a predicate device for AroCell TK 210 ELISA in this 510(k) application and regulatory process is that the intended use is innovative and something similar is not on the market. This at the same time makes the product unique as it will meet a need where there is no product today.”
“From a regulatory perspective, it was surprising to receive this information so late in the process. At the same time, the FDA has announced that they want to continue the dialogue regarding the product after we have now withdrawn this application. This is unusual but also positive as it enables us to analyze and map the way forward more quickly.”
Yrityksessä (Arocell) itsessäänkin siis ihmetellään miten tämä hakemus on voinut näin pitkälle edetä ja näin kauan kestää ja vasta tässä vaiheessa todetaan, että hakemus olisi pitänyt tehdä nimenomaan DeNovona eikä 510k:na. Aluksi ajattelin, että Arocell itse möhlinyt hakemuksen väärään paikkaan, mutta tosiaan aika harvalla yrityksellä on datapankkeja/resursseja selvittää kumpi hakemus tulisi tehdä (ellei nyt hae uutta predikaattia jollekin laitteelle jonka oma yritys aikaisemmin rekisteröinyt), joten siksi FDA suosittelee noita Pre-Submissioneita, jotta hakijoiden prosessi helpottuisi ja nyt ihan lähtökohtaisesti edes se hakemus menisi oikeaan paikkaan. Eipä auta kun jäädä odottelemaan uutisia, että miten tästä jatketaan. Ilmeisesti nyt ainakin tuon DeNovon kautta. Toivottavasti virhe on ollut nimenomaan FDA:n päässä ja sieltä saataisiin hieman armoa nopeennetulla DeNovo hakemuksen käsittelyllä. Ainakaan aivan samanlaisella liukuhihnatahdilla noita DeNovo hakemuksia ei näyttäisi olevan verrattuna 510k hakemuksiin. Tähän mennessä vuonna 2021 tehty vain 15 päätöstä, vuonna 2020 tehty 26 päätöstä ja vuonna 2019 tehty 23 päätöstä. Jos joku haluaa noita tutkia niin tässä linkki: Device Classification Under Section 513(f)(2)(De Novo) Muista painaa “search” niin lista aukeaa.
E: Avanzan Arocell ketjun yksi aktiivisimmista (ja mielestäni parhaista) kirjoittajista on kommentoinut tapausta vapaasti suomennettuna näin: “De Novon käsittelyaika on tähän mennessä ollut huomattavasti lyhyempi, kun NSE (not substantially equivalent) on määritelty aiemman 510k hakemuksen perusteella. Esimerkiksi vuonna 2015 De Novo näyttää menneen alle puoleen ajasta jos hakemus perustui 510k NSE:hen verrattuna siihen, että hait DeNovoa suoraan alusta alkaen.” Eli datan perusteella voisi nopeennettu käsittely olla jopa mahdollista. Tätä ei toki kannata ottaa sijoitussuosituksena ja kannattaa pitää mielessä, että korona saattaa edelleen aiheuttaa viivästyksiä kaikenlaisille hakemuksille (kuten olemme huomanneet).