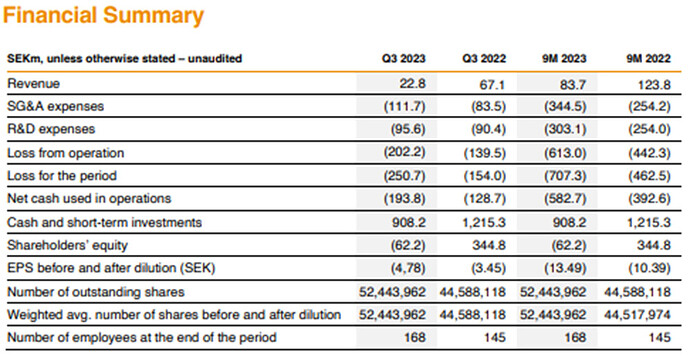
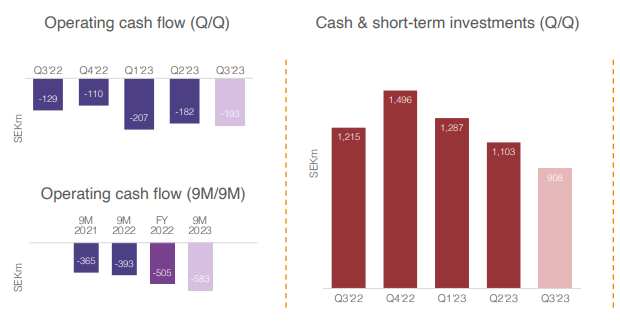
Klaus Sindahl puhui taas Penserin vieraille: Hansa Biopharma presentation - Penser South. Jälleen mielenkiintoisin anti oli lopun Q&A. Tässä tuli ihan merkittävää uutta infoa AMR:sta. Seuraan jonkin verran muitakin keskustelupalstoja, ja mielestäni tätä ei vielä ole tuotu missään esiin. Hansa on toki sanonut, että faasi III tulisi olemaan vaikea tämän indikaation kanssa, eli sikäli ei ole valtavasta yllätyksestä kyse.
Q: Mitä tapahtuu AMR faasi II:n jälkeen? A: Sindahl vihjasi siihen suuntaan, että faasi III:a ei tule (21:00). Se vaatisi satoja potilaita ja vuosikausien seurannan, ja olisi nykytilanteessa liian kallista. Jatkokysymykseen vastaus oli, että toiveena on imlifidaasin off-label -käyttö (vain) erittäin vakavissa AMR-tapauksissa. Tästä voisi myös tulkita, että tähän indikaatioon ei ainakaan nyt lähdetä edes hakemaan hyväksyntää pelkän faasi II:n perusteella.
Jos uskotaan, että AMR jää faasi II-vaiheeseen ilman lupahakemuksia, voidaan todeta seuraavaa: Kassavirran kannalta tämä on hyvä uutinen; kallista ja hidasta faasi III-tutkimusta ei tule. Toisaalta mielestäni nyt joudutaan ikään kuin jättämään pois tämä AMR-indikaatio Hansan pipelinesta, eli seitsemästä kliinisen vaiheen indikaatiosta yhden eteneminen pysähtyy. Hansa ei voi markkinoida eikä edistää imlifidaasin käyttämistä indikaatioon, johon sitä ei ole hyväksytty. Tällä strategialla imlifidaasista ei mielestäni voi tulla standard-of-care edes vakaviin AMR-tapauksiin, vaan tämä off-label -käyttö vaatii tapauskohtaisen tarkastelun. Se jäänee vain kaikkein vakavimpiin tapauksiin pelastamaan potilas muuten varmalta elimen menetykseltä niille klinikoille, joilla muutenkin on imlifidaasista kokemusta. Näin ollen en oikein näe, että AMR:n kanssa päästäisiin lähellekään analyytikoiden ennustamia 1000+ potilaan vuosittaisia EU+US peak sales-lukumääriä.
Jos akuutin AMR:n esiintyvyys on 5 % munuaissiirroista, ja näistä 10 % johtaa munuaisen menettämiseen nopeasti akuutin AMR:n jälkeen, voisi näitä erityisen vakavia akuutteja tapauksiakin kuitenkin olla suuruusluokaltaan 200+ tapausta EU+US-alueella yhteensä (voitaisiin myös käyttää jopa lukuja 7 % ja 30 % riippuen rajauksesta). Olisikin mielenkiintoista kuulla, mitä joku paremmin kenttää tunteva on mieltä asiasta; onko realistista olettaa, että 300k eur maksavaa lääkettä käytettäisiin AMR-tapauksiin tällaisia määriä off-label? Jos (ja uskoakseni kun) faasi II full data vahvistaa, että imlifidaasi voisi pelastaa ison osan näistä arvokkaista munuaisista, olisi tähän tietty insentiivi. Kalliita syöpälääkkeitä käytetään ilmeisen paljonkin vastaavasti, sillä ei ole järkevää tai edes mahdollista tutkia ja hyväksyttää jokaista lääkettä ja lääkeyhdistelmää erikseen jokaiseen harvinaiseen indikaatioon. Tutkimusten mukaan USA:ssa 30-50 % syöpälääkemääräyksistä on off-label. Toisaalta ”kalliin” syöpälääkkeenkin hinta per potilas saattaa olla 10 % Idefirixin hinnasta. Ei tässä varmaan ainakaan lähivuosina merkittäviin AMR-myyntimääriin päästä? Korvausasiat pitäisi myös olla etukäteen selvillä.
USA:ssa imlifidaasin käyttöä AMR:ään vaatinee FDA:lta tapauskohtaisen poikkeusluvan, kunnes imlifidaasi on hyväksytty siellä munuaissiirtoihin (tai johonkin muuhun indikaatioon). Kun imlifidaasi saa FDA-hyväksynnän munuaissiirtoihin, muuttuu off-label -käyttö ymmärtääkseni selvästi helpommaksi.
Euroopassa Idefirixillä on ehdollinen hyväksyntä. Off-label-myynti on siten helpompaa. Pikaisella googletuksella vaikuttaisi siltä, että tässä(kin) asiassa on merkittäviä kansallisia eroja siihen, miten off-label-käyttöön suhtaudutaan. Esimerkkejä:
for example France and Italy explicitly allow for reimbursement of off-label use also when (on-label/authorized/not strictly identical) alternatives exist.
The Netherlands where off-label prescription is only allowed if the relevant professional body has developed protocols or professional standards with regard to that specific off-label use.
Aikaisemmin Hansalta on vastattu erittäin varovasti kysymyksiin imlifidaasin/Idefirixin off-label -käytöstä. Tämä on siihen nähden muutos linjaan. Onkohan liian pitkälle vedetty johtopäätös, että samaa strategiaa lähdetään ajamaan tulevaisuudessa joidenkin muidenkin indikaatioiden kanssa? On aika liuta harvinaisia indikaatioita, joiden vakavissa muodoissa imlifidaasista voisi olla hyötyä, mutta joissa täyden kliinisen koesarjan ja viranomaislupien yms hakeminen ei ole ainakaan nykytilanteessa panos-tuottosuhteeltaan järkevää. AMR:n kohdalla itse näen tämän ainakin tässä vaiheessa niin, että myyntiä voisi tulla jo aiemminkin kuin itse olin arvioinut, mutta indikaation riskikorjaamaton arvo tullee jäämään pienemmäksi kuin aiemmissa arvioissa. Riskikorjattuna asia ei välttämättä muutu, sillä tällä strategialla riski pienenee merkittävästi (kun nyt oletetaan että faasi II full data on odotetun hyvää), mutta myös potentiaali pienenee. Ehkä tämän nyt kokonaisuuden kannalta kuitenkin enemmän negatiivisen kuin positiivisen puolelle kallistuu?