Chemotech sisäpiiriläinen Bengt Engström toistamiseen tässä kuussa lisännyt omistustaan yhtiössä.
9.3 lisännyt 3000 ja osakkeita hänellä yhteensä 46 000 kpl.
Tänään tuli InsynsAppiin, että lisännyt pe 18.3 osakkeita 3400 kpl.
Herra on myös mukana mm. Scanfil OY:n hallituksessa.
Aika vähäistä osakkeen päivä vaihto ollut verrattuna viime toukuuhun.
Moberg Pharma on nyt jättänyt myyntilupahakemuksen EMA:lle liittyen topikaaliseen kynsisienilääkkeeseen (MOB-015) ja tavoitteena myynin aloitus 2023. Myyntilupahakemus myöhästynyt muutamalla kuukaudella Ruotsin lääkevirastosta johtuvista syistä.
Calliditakselle erittäin hyviä uutisia:
EMA:lta (European Medicines Agency) tuli juuri vihreää valoa munuaislääkkeen hyväksynnälle EU:n alueella (+ Islanti, Norja, Liechtenstein). Seuraavaksi vielä muodollinen hyväksyntä Euroopan komissiolta - ja sitten vain myyntiin Euroopassakin. Jenkeissä sama lääke on jo myynnissä TARPEYO-nimellä. Calliditasin tulevaisuus näyttää kyllä hyvältä. Alla tuore info asiasta.
"Calliditas Therapeutics AB (Nasdaq: CALT, Nasdaq Stockholm: CALTX) (“Calliditas”) today announced that the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) adopted a positive opinion recommending the granting of a conditional marketing authorisation for Kinpeygo[TM] for the treatment of primary immunoglobulin A (IgA) nephropathy (IgAN) in adults at risk of rapid disease progression with a urine protein-to-creatinine ratio (UPCR) ≥1.5 g/gram. If confirmed by the European Commission (EC), Kinpeygo will be the first and only approved treatment for IgAN, a rare, progressive autoimmune disease of the kidney with a high unmet need, with more than 50% of patients potentially progressing to end-stage renal disease (ESRD). Upon approval Kinpeygo, which was developed under the name Nefecon, will be marketed exclusively by STADA Arzneimittel AG.
The CHMP’s positive opinion will now be forwarded to the EC, which has the authority to grant a marketing authorisation for Kinpeygo in the European Union (EU) member states, and which will be adopted by Iceland, Norway and Liechtenstein. A final decision by the EC on granting a marketing authorisation is anticipated in Q3 2022. Kinpeygo is already marketed under an accelerated approval in the United States under the brand name TARPEYO[TM].
“This is a great outcome, which reflects the strong clinical results from our Phase 3 trial. We are delighted that patients suffering from IgAN in Europe will hopefully soon be able to access a drug developed specifically to target this disease.” said CEO Renée Aguiar-Lucander.
In May 2021, Calliditas announced that it had submitted a Marketing Authorisation Application (MAA) to the EMA, which had previously granted Orphan Drug Designation to this drug candidate in the treatment of IgAN. In July 2021, Calliditas and STADA announced that the two companies had entered into a license agreement to register and commercialize Kinpeygo in the European Economic Area (EEA) member states, Switzerland and the UK.
If confirmed by the European Commission (EC), Kinpeygo will be granted a conditional marketing authorisation that is based on achievement of the primary endpoint of reduction of proteinuria in Part A of the NeflgArd pivotal Phase 3 study. Patients taking 16mg of Kinpeygo once daily showed a statistically significant 31% reduction in proteinuria from baseline vs 5% in the placebo arm after 9 months of treatment."
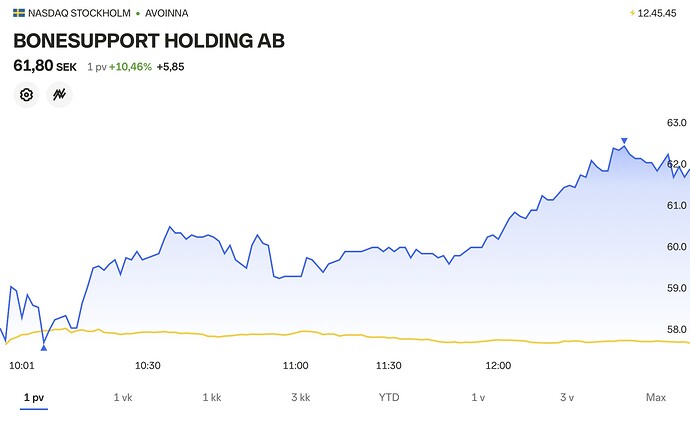
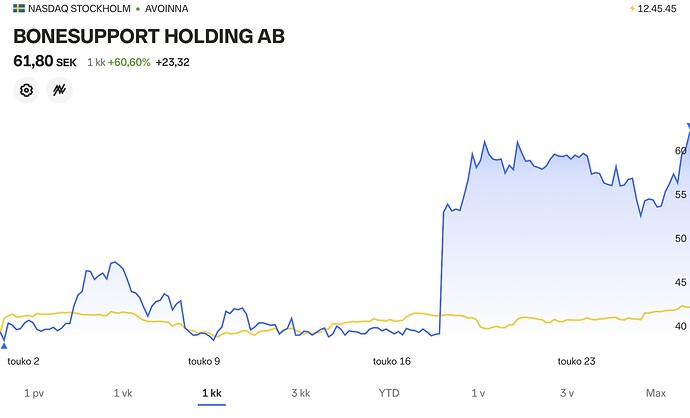
Carnegiekin ehti lopulta mukaan Bonesupportin kelkkaan. Aikaisempi tavoitehinta 55 kruunua nousi kerralla 105 kruunuun, suosituksella osta. Bonesupportin luulääke sai FDA:n hyväksynnän toissaviikolla, tuon alemman kuvaajan vuorenseinämän kohdalla.
Vertailun vuoksi… AGB:n toissaviikolla kohottama tavoitehinta on 95 kruunua (ent. 65 kr), suosituksella osta. AGB korosti, että sen tavoitehinta perustuu hyvin varovaisiin laskelmiin, jossa Bonesupport saa luutulehduslääkkeelleen 9 % markkinaosuuden 2024 loppuun mennessä. Bonesupport itse arvioi saavansa jopa 60 % markkinaosuuden.
Pareto aloitti Calliditasin seurannan. Osta-suositus ja 300 kruunun tavoitehinta. Eilinen päätöskurssi oli 84,35 kruunua.
Callditias sai kaksi viikkoa sitten EMA:lta (European Medicines Agency) vihreää valoa munuaislääkkeen hyväksynnälle EU:n alueella (+ Islanti, Norja, Liechtenstein). Seuraavaksi on vuorossa muodollinen hyväksyntä Euroopan komissiolta - ja sitten vain myyntiin Euroopassakin. Jenkeissä sama lääke on jo myynnissä TARPEYO-nimellä, FDA-hyväksyntä tuli viime vuoden loppupuolella.
EDIT. Niin ne suositukset vain painaa. Viisi minsaa pörssin aukeamisen jälkeen kurssi yli kymmenen prosentin nousussa (nyt 94 kruunua).
Tässä vielä Pareton perusteluja Calliditaksen 300 kruunun tavoitehinnalle, blockbuster-statusta ennustellaan, eli yli miljardin dollarin myyntiä vuodessa:
"Pareto estimates that the research company Callidita’s drug Tarpeyo (developed as Nefecon), which is used to treat the rare autoimmune disease IgA nephropathy, will achieve blockbuster status in the US by 2024. Blockbuster status means that the drug sells for over $ 1 billion annually.
“We forecast $ 60 million in sales in 2022 and blockbuster status in the US / Europe in 2024/2026. Therefore, we believe that the stock, which is currently trading below its pre-phase 3 reading levels, is highly undervalued,” the bank wrote in an initial analysis. sets purchases and a target price of SEK 300.
Furthermore, Pareto points out Calliditas as a takeover candidate. “While Novartis LNP023 is the only threat on the horizon that could be realized during H2 2024, Novartis is also a potential acquirer if Calliditas succeeds in increasing sales as we expect, with the first and only drug in a major best-selling indication,” the bank estimates."
Analys Kepler Cheuvreux inleder bevakning av specialistläkemedelsbolaget Calliditas Therapeutics med rekommendationen köp och en riktkurs på 140 kronor.
Läkemedlet Tarpeyo vid behandling av den sällsynta njursjukdomen Iga nefrit uppges ha en fördel av att vara den första godkända produkten i USA så kallat ”first mover advantage”.
Kepler Cheuvreux förväntar sig att försäljningsvolymen av Tarpeyo kommer att börja accelerera under det andra halvåret 2022 då en bred kostnadstäckning i USA kommer att finnas på plats.
Under perioden 2022 fram till 2025 väntar sig Kepler Cheuvreux en snabb försäljningstillväxt för Tarpeyo. För tiden därefter förväntar sig Kepler Cheuvreux en ökad konkurrens, vilket väntas bromsa in tillväxten till 2028 då försäljningen väntas nå en topp på 4,8 miljarder kronor. Det motsvarar ett upptag om 9 procent av Tarpeyos kärnmarknad enligt Kepler Cheuvreux.
Swedbank nosti AstraZenegan ja Calliditaksen sektorifaneihinsa:
"När det gäller Calliditas är uppsidan desto större, närmare bestämt nästan 50 procent med riktkursen 140 kr.
Här lyfts bioteknikbolagets produkt Tarpeyo som en drivkraft för bolaget. Det är den första behandling som har beviljats godkännande av FDA för att reducera proteinuri hos vuxna med primär IgA-nefropati (IgAN).
”Kommersiell lansering har skett i USA och tillväxten väntas nu ta fart under andra halvåret i år, skriver Kepler Cheuvreux analytiker och spår att den pågående lanseringen på USA-marknaden (som motsvarar 80 procent av uppskattat värde i Calliditas) kommer att bli framgångsrik.
22.6. tosin CALTX laskussa -4% ![]()
Valneva on ollut tämän päivän haltissa Pariisissa. Nyt ne ilmoittavat saaneensa Euroopan lääkeviraston suosituksen myyntilupaa varten inaktivoiduista viruksista valmistetuille COVID-rokotteelle. Kurssi keulii kivasti ainakin Nasdaqissa nyt, mutta Valnevalla on kyllä ollut taipumusta olla todella volatiili joka suuntaan.
Ei siis myyntilupaa vielä, mutta suositus.
Minusta Novon osinkotuotto on alhainen vs monet muut lääkeyhtiöt. Arvo on kuitenkin noussut tasaisesti.
Mielenkiintoinen yhteistyö MS ja Novo. Luin tämän hätäisesti ensin väärin ja luulin sen liittyvän huumeiden käyttöön, mutta sittenkin kyse AI:sta lääkkeiden kehityksen apuna.
Calliditasissa on riittänyt parina päivänä vuoristorataa. Eilen tapahtui ilmeisesti jonkinasteinen kapitulaatio. Kurssin laskettua voimakkaasti.
Juuri julkaistu tieteellinen artikkeli Calliditasin kehittämän lääkkeen vaikutuksista:
https://www.kidney-international.org/article/S0085-2538(22)00836-5/fulltext
Kaikki artikkelin tiedot olivat FDAn käytössä sen annettua ehdollisen luvan lääkkeen myynnille.
Toimitusjohtaja Renee on hyvin vakuuttavan tuntuinen haastattelussa:
Professori Jonathan Barratt, joka toimi tieteellisen artikkelin kirjoitusryhmässä on niin ikään luottavainen ja haastattelun loppupuolella tyrmää erään SEBin käyttämän analyytikon lausunnot (joka sai kapitulaation aikaan!).
SEBin käyttämä asiantuntija on jopa keskusteluissa jäävätty, koska hänen vaimonsa työskentelee kilpailevassa lääkeyrityksessä.
(RETRANS) ChemoTech’s Animal Care division signs Letter of Intent with a prominent player in the North American veterinary market
Wed, Oct 19, 2022 08:30 CET Report this content
Retransmission of press release that was issued on 18 October 2022 at 23:55.
Scandinavian ChemoTech can gladly state that its subsidiary Vetiqure AB is close to securing a very impactful distribution agreement with Avante Animal Health in the United States.
The Letter of Intent (LOI) clearly outlines a very detailed arrangement for a planned distribution agreement. It also specifies the aim to install approximately six vetIQure™ systems at various university hospitals and leading clinics, which are already clients of Avante Animal Health. These systems are to be installed at the end of 2022 and then undergo an evaluation period for 3 months at each designated location. After the evaluation period, the detailed plan in the LOI will be transferred to the distribution agreement; which states that a joint target between Vetiqure AB and Avante Animal Health is to sell or lease out approximately 50 vetIQure™ devices and 2,000 kits over the next two years.
“Today was a great success and a long time coming after months of deliberation and analysis on both ends of both companies.” - says Danny Nesrallah, Head of Business Development in North America
“Even if we have not yet reached the final distribution agreement, this demonstrates a consensus on the most important points in the forthcoming distributor agreement. We are all very happy with how the dialogue has proceeded, and we have so far only witnessed positive feedback from our veterinarians in Europe and USA when it comes to the performance of TSE. We are confident that these evaluations will result in a signed distribution agreement. We feel very much aligned and look forward to our collaboration with the Avante team, which has shown us a very professional attitude throughout the negotiations.” – says Mohan Frick, CEO
About Avante Animal Health www.avantevet.com
Avante Animal Health, formerly known as DRE Veterinary, is a division of Avante Health Solutions. For more than 30 years, Avante Animal Health has provided new and professionally restored medical equipment to veterinarians, veterinary surgery centers, research facilities, universities, and technical schools. Veterinary facilities rely on Avante to provide products and services that save time and money, allowing veterinary surgeons to do what they do best.
For further information please contact: Mohan Frick, CEO
LOI, mutta kuulostaa lupaavalta ainakin itselleni.
Calliditasilla hyväksyntä Kiinassa:
Eilisessä q3:ssa todettiin:
With approval and commercial efforts now ongoing in both the US and Europe, we are looking forward to the regulatory process in China, where our partner, Everest Medicines, expects to receive NDA acceptance notice from NMPA this quarter.
Tänään yhtiö tiedottaa hyväksymisestä:
“It is exciting that Everest’s NDA has been accepted by the NMPA, providing a path forward to address the very significant patient population suffering from IgAN in China. We look forward to continuing our collaboration as we focus on bringing novel solutions to patients” said CEO Renée Aguiar-Lucander.
Edit: tässä on siis tärkeää ymmärtää, että Calliditas ei saanut markkinointilupaa, vaan NMPA hyväksyi vasta, että hakemus markkinointiluvalle voidaan jättää! (Hitaasti hyvää tulee toivottavasti)
TUKHOLMA (Nyhetsbyrån Direkt) Astra Zeneca on saanut Japanissa hyväksynnän yhdistelmähoidolle Imfinzi- ja Imjudo-immunoterapialääkkeellä sekä kemoterapia edenneen maksasyövän, ei-pienisoluisen keuhkosyövän ja sappitiesyöpään.
Biotage AB. Ruotsalainen 1969 perustettu yhtiö, toimarina 2019 alkaen Tomas Blomqvist jolla aiempaa kokemusta mm. Abbottilta, Rochelta, Johnson & Johnsonilta ja Analyticon Biotechnologiesilta.
Toimialana “Drug Discovery, Analytical Sample Preparation and Environmental Testing”. (https://www.biotage.com/). Toimintaa ja tuotteita mm. viruspohjaisessa geeniterapiassa ja ympäristöystävällisessä tutkimusvälineistön puhdistamisessa.
Tuntuisi hyvin sopivan omaan salkkuun Genoviksen kumppaniksi. Osaako foorumi palastella yritystä enemmän?