En ole nefrologi, mutta ihan mielenkiintoinen firma. Pitää perehtyä lisää, kun jaksaa. Tästähän voisi tehdä oman ketjunsa, jotta kollegio pääsee kommentoimaan lisää? Finan ja fundan puolesta joku muu osaa ottaa paremmin kantaa  Pahoittelut huonosta jäsentelystä. Tässä kommentoin vain Tarpeyoa ja IgA-nefropatiaa. Sparsento myös mielenkiintoinen ja tätä ehkä käytetään jatkossa laajemmin kuin Tarpeyoa.
Pahoittelut huonosta jäsentelystä. Tässä kommentoin vain Tarpeyoa ja IgA-nefropatiaa. Sparsento myös mielenkiintoinen ja tätä ehkä käytetään jatkossa laajemmin kuin Tarpeyoa.
Hyvin lyhykäisyydessään kallis lääke, samantyylinen kuin systeemiset glukokortikoidit, mutta vähemmät haitat. Taitaa olla toistaiseksi ainoa lääke, jolla GFR-arvoon vaikutusta hetkellisesti. Säästettäneen jatkossa potilaille, joille BSC (basic support care) ei riitä ja tauti on aktiivinen eikä voi käyttää halpoja glukokortikoideja tai mykofenolaattia.
Sitten pidempi versio:
BSC (basic supportive care, lähinnä hidastavaa hoitoa) sisältää nykyisin verenpaineen hoidon etenkin ATR-salpaajalla (verenpainelääke vaikuttamassa reniini-angiotensiini-aldosteronijärjestelmään) + SGLT2 (munuaiprotektiivinen lääke, joka laskee verenpainetta, käytetään myös diabetekseen ja sydämen vajaatoimintaan) + elintapahoito. Nyt näillä uusilla lääkkeillä pyritään jopa osin ainakin hetkellisesti parantamaan tautia, ainakin eGFR:n (munuaisten suodatusnopeus, korkea arvo parempi) perusteella voisi näin ajatella Tarpeyon osalta.
Alin artikkeli kertoo, että Sparsentan + SGLT2 kannattanee jatkossa laittaa perushoitoon mukaan tavallisen ATR-salpaajan tilalle.
Tarpeyo siis kallis (“A major constraint to the widespread use of TRF-budesonide is its economic cost ($14,160 for 1 month of treatment)”), omat haittansa ja hyöty laskee käytön loputtua, kuten systeemisillä glukokortikoideilla. Kuitenkin haitat vähäisemmät kuin laajemmin systeemisesti vaikuttavissa glukokortikoideissa ja Tarpeyolla näyttäisi olevan paikka hoidossa, kun glukokortikoidit on kontraindisoitu. Immunosupressiivista mykofenolaattia tai hydroksiklorokiinia käytettäneen myös näillä potilailla, joille glukokortikoidit eivät sovellu (vanhempia lääkkeitä). Näistä etenkin mykofenolaatti kilpailee Tarpeyon kanssa samasta paikasta hoidossa etenkin hintansa puolesta.
Kohtalaisesti siis Tarpeyolla haittoja, joista ainakin verenpaine ja akne on yleensä hoidettavia, mutta lihasspasmit on ikävä lisä ja näiden hoitaminen on vaikeaa ilman että lääkityksen purkaa ja potilaat todnäk näistä valittaisivat melko paljon. Toki voi miettiä, onko munuaisten vajaatoiminnan nopea kehittyminen vai haitat hankalampia. Turvottelun osalta toki diureettia voi lisätä, mutta Krea tästä voi nousta ja eGFR siis laskea. Lisäksi altistanee etenkin joillakin potilailla vatsahaavoille, GI-vuodoille, hypokortisolismille / HPA-akselin häiriöille ja osteoporoosille, kuten laajemmin vaikuttavat glukokortikoidit.
Ts. vaikka lääkettä ilmeisesti markkinoidaan ilmeisen paikallisesti vaikuttavana, niin kyllä haittojen perusteella näyttäisi olevan systeemihaittoja, jotka mainintana myös turvallisuustiedotteissa.
Novel Treatment Paradigms: Primary IgA Nephropathy -artikkelista:
“The drug was generally well-tolerated; however, hypertension (15.% vs. 2%), edema (15.5% vs. 4%), muscle spasms (13.4% vs. 4%), and acne (11.3% vs. 2%) were reported more frequently with nefecon compared to placebo.”
Tarpeyolla proteinurian määrä laski 9 kk aikana n. 27 % vs. Sparsentanilla (DEARA, dual endothelin angiotensin receptor antagonist) melkein 50 %. Jälkimmäisellä haittoina turvotus, matala verenpaine ja tästä todnäk johtuva huimaus, jotka mielestäni paremmin siedettäviä vrt. Tarpeyo.
Mikä Tarpeyossa vaikuttaisi olevan hyvää vrt. Sparsentan, on eGFR nousu eli munuaisfunktion korjaantuminen 9 kk kohdalla, mutta tämän jälkeen eGFR lähtee taas laskuun. Sparsentan vain hidastaa eGFR:n laskua.
Pitää huomioida, että näillä kummallakin lääkkeellä lienee jatkossa oma paikkansa hoidossa, kuten alempana kohta näkyy.
Ilmeisesti joitakin tutkimuksia USA:ssa on tehty Tarpeyon kustannustehokkuudesta eliniän lisäyksessä ja ainakin parin tutkimuksen mukaan hyödyllinen lääke olisi. Kallis silti 
Lyhyt ja informatiivinen review-artikkeli:
s41581-023-00804-y.pdf (1,0 Mt)
Laajempi artikkeli nykyhoidoista, melko uusi ja pitää tätäkin lukea vielä tarkemmin:
treatment_of_iga_nephropathy__a_rapidly_evolving.12.pdf (845,4 Kt)
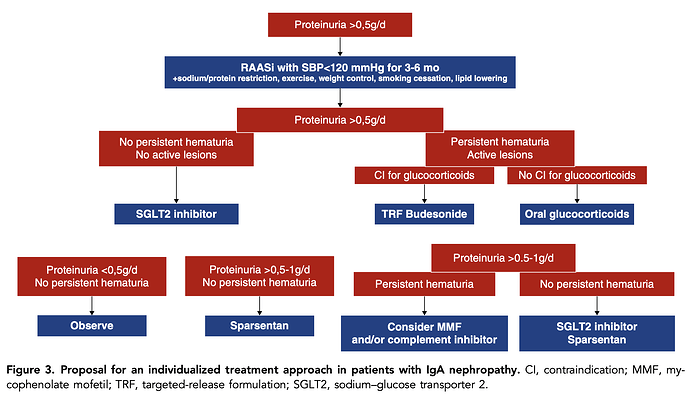
Alla vielä ehdotelma hoidosta IgA-nefropatiassa nykyisin / jatkossa (TRF Budesonidi = Tarpeyo):
“TRF-budesonide is a promising alternative to oral glucocorticoids, assuming equal or better efficacy and lower toxicity, although no direct comparisons are available. However, its high economic cost calls for restrictive use and careful cost–benefit considerations. We suggest to reserve it for patients with
severe contraindications to oral glucocorticoids. MMF (= mykofenolaatti) with or without lowdose steroids could also be proposed in patients with contraindications to highdose steroids. The evidence in favor of complement inhibitors is still preliminary but very encouraging. We believe they should not be given as monotherapy but rather as adjunctive treatment to oral glucocorticoids or TRF-budesonide in patients with severe and active disease. Therapies directed at CD38, BAFF, and APRIL still have to prove value but may hopefully replace or complement broad immunosuppressants in the future. Although the evidence on hydroxychloroquine is scanty, it may be a good choice in patients with residual proteinuria after other treatment options have been exhausted.”
Jatkossa lienee mielenkiintoisia Felzartamab (CD38-inhibiittori), jolla faasi 2a tutkimukset menossa, Atacicept (sytokiiniestäjä, estää lopulta IgA1 syntyä ja tämä sinällään hyvin mielenkiintoinen), jolla faasi 2 tehty.
Voisi kuvitella, että esim. Ataricecptiä ja Tarpeyoa voitaisiin jatkossa käyttää yhdessäkin?
OFFTOPIC:
Huomioiden proteinurian ja GFR:n yhteys (proteinurian väheneminen on yhteydessä paremmin säilyvään GFR:ään) voisi kuvitella, että Sparsentan on jopa tehokkaampi. Mutta näyttäisi ainakin tutkimusten perusteella Tarpeyo tehokkaammalta GFR:n osalta. Tässä voi spekuloida, että voiko Tarpeyolla olla hetkellisen oikean munuaisprotektiivisen vaikutuksensa lisäksi glukokortikoidien mahdollisesti plasmavolyymia nostavan vaikutuksensa kautta myös vaikutus suoraan laskennalliseen GFR-arvoon (eli nesteen määrä kudosten lisäksi veressä kasvaa ja kun kropassa on enemmän nestettä, niin laskennallinen GFR paranee).