Olisi mielenkiintoista tietää, millainen teho olisi jos sitä käytettäisiin osana jo ensivaiheen hoitoa. Käsittääkseni nyt tutkimukseen otetuista potilaista kaikki ovat jo käyneet läpi ns. normaalin hoitolinjan, mistä ei tehoa ollut löytynyt.
Juu, sehän tulee varmaan sitten kun on saatu varmuus kokemuksen kautta.Alkuunhan niitä testataan NS.epätoivoisille potilaille,siis kun on siirrytty ihmisiin.Sekin kertoo jo että on aika ennennäkemätön lääke syövän saralla.Vuosia siihen menee, mutta näin varmasti on tulevaisuudessa.
Näin itsekin ajattelisin, koska oma immuunipuolustus on normi hoitojen jälkeen aika huonossa jamassa. Silti tämä Faronin lääke toimii.
Tuossa aiemmin linkatussa jutussa pelkällä Azalla ”Complete remission (CR) was achieved in 14% of MDS, 7% of AML and 10% of CMML patients. Overall response rate (ORR) including CR, partial response (PR) and hematological improvement (HI) was as follows: 27% for MDS, 20% for AML and 20% for CMML.”
Varmaankaan, jos Bexin vasteet ovat kuten nyt on nähty, ei ole lääkäreitä, jotka kysyisivät potilaaltaan, että haluatko ensin vain lääkkeen (Aza), joka ei auta 73-86 %:n varmuudella? Siis EI auta. Tai että olisi potilaita, jotka nimenomaan pyytävät pelkän lähes tehottoman lääkkeen? Ja annetaan taudin edetä ja kunnon heikentyä, kun ei tullut vastetta.
En näe eettisesti mahdolliseksi kuvaamaasi tilannetta, että (edelleen Bexin tutkimusvasteiden jatkuessa hyvinä=myyntilupa on myönnetty) Bexia ei annettaisi Azan tai jonkun muun lisänä kaikille ensilinjassa). What say you?
Näin asia varmaankin voisi olla käytännössä lääkärien kautta.
Itse myyntilupahan myönnetään tehdyn tutkimuksen ja hakemuksen mukaisesti, mutta käytännössä lääkärit voivat määrätä lääkettä siten kuin parhaaksi näkevät mm. ensimmäiseen hoitolinjaankin.
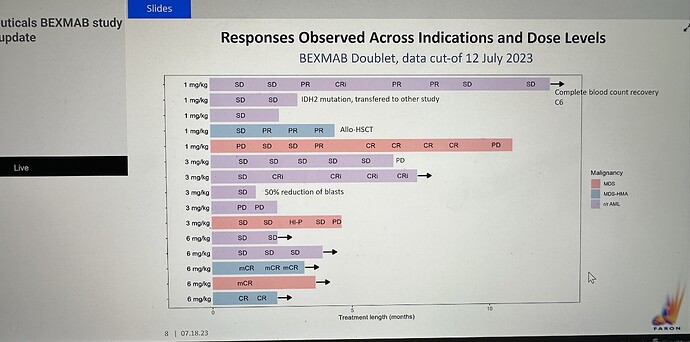
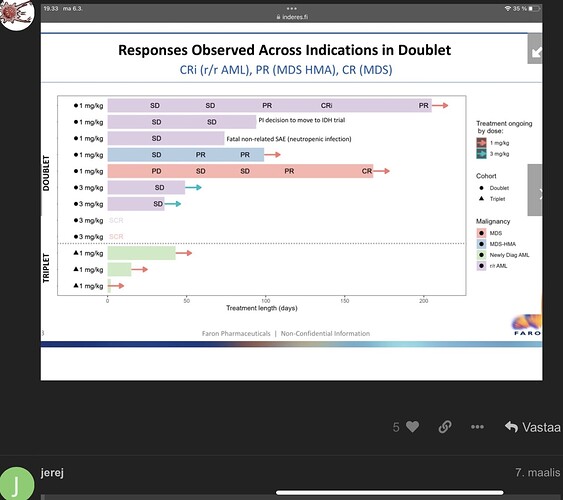
Tämä voisi toteutua varsinkin MDS:n osalta, kun Faronin nykyisten tulosten perusteella BEX näyttäisi tehoavan kaikkiin tutkimuksessa mukana olleisiin MDS-potilaisiin 6/6, mikäli oikein luin tuota liitteenä olevaa diagrammia.
MDS:stä voi parantua vain kantasolusiirron avulla, joka jää harvinaiseksi hoidoksi potilaiden iän vuoksi (suurin osa yli 60-70 vuotiaita, joka aiheuttaa riskiä kantasolusiirtoon).
MDS:n elinajanodote alkuperäisestä diagnoosista on hyvin lyhyt kuukausista muutamaan vuoteen ainoastaan eli kyseessä on todella agressiivinen sairaus, johon todellakin tarvitaan Bexmarilimabin tyylinen lääke mukaan hoitoihin.
Lyhyt elinajanodote diagnoosin jälkeen liittyy paljolti myös siihen, että potilaat ovat varsin vanhoja, usein yli 80-v.
Näin on. Silloin, kun on kyse turvalliseksi osoittautuneesta lääkkeestä ja tauti on vakava eikä muita hoitokeinoja ole olemassa, on mahdollista saada ehdollinen lisätutkimuksia edellyttävä määräaikainen myyntilupa jo faasi 2 perusteella. Esimerkkinä vaikka atezolizumabi Tecentriq levinneeseen virtsarakon syöpään Rochen atetsolitsumabille ehdollinen myyntilupa virtsarakon syövän hoitoon Yhdysvalloissa
”the ORR was 24% (95%CI 16-32), CRR was 8%, and median duration of response was not reached (95%CI 30.4 months to NR; 19 of 28 responses ongoing)”
Faasi 1/2 tutkimuksen perusteella EMA suositteli myyntilupaa hoitoresistenttiin myeloomaan tuloksilla ”63% of patients enrolled in the study responded to the treatment with Tecvayli, and median progression-free survival was 18 months”
Nämä päätökset eivät tietenkään ole tae tulevasta. Ja nyt puhutaan siitä, että Faron puuhaa itse omilla kapeilla hartioillaan tietä markkinoille vakuuttaakseen viranomaiset. Missä vaiheessa ja millä tuloksilla leveämmät hartiat ottaisivat syleilyynsä, on toinen kiinnostava juttu.
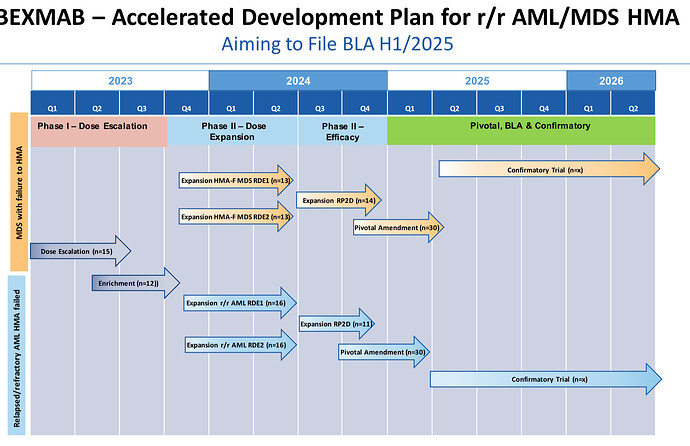
Ehkä em. päätöksiinkin peilaten Faron (ainakin Saxin kommenttien mukaan) toivoo saavansa BEXMABissa vähintään 50 potilasta kasaan ja sitten hakevat nopeutettua hyväksyntää, johon kaipaisivat vain 25 %:ssa OR ja 5 kk:n odotettuun elinaikaan vain 3 kk lisää. 15 potilasta on jo per 12.7.23 ja nyt 6 saittia, Yale ja UNC avaavat Q3. Helppoja nakkeja tällä menolla?
Sinänsä Bex näyttää liittyvän tavallisten kuolevaisten joukkoon, syöpä näyttää väistämiskykynsä, joka vaikuttaa kaikkeen syöpähoitoon, Bexista huolimatta tauti voi lopulta edetä eli tulee tuo kalvon PD. En nähnyt webcastia (QA) ja sitä ei näytä olevan vielä jaossa, oliko kommunikoidut tavoitteet noin?
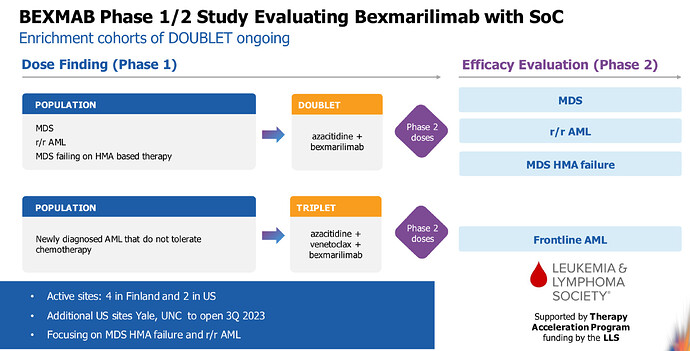
Yksi asia, jota ei viestitä, on triplettihoito eli jossa on myös venetoklaksi eli tuoreet leukemiat. Ensimmäisethän aloittivat jo puoli vuotta sitten. Lisäksi slidessä ”focusing on MDS HMA gailure and r/r AML”, mikä voisi tarkoittaa joko sitä, että tuoreessa AML:ssä ei ole näkynyt järisyttävää tehoa tai sitten järkeillään, että Bexin tehon näyttö on nopeinta/taloudellisinta noissa epäonnistuneissa eli failurehoidoissa, koska se on lisähoito ja siten selittävä tekijä. Tripletissä ei tiedä, mikä kolmesta tehosi…ehkä myöhemmin tuokin tehdään.
Ymmärtääkseni tätä ei ole vielä edes kokeiltu tuoreessa AML:ssä hoitona. Veikkaisin, että tässä on tarkoitus ensin saada Bex markkinoille r/r AML:n hoitoon, jos siihen on mahdollisuus saada nopeutettu lupa jo faasin II tulosten perusteella, ja sen jälkeen tehdä myöhemmin erilliset kokeet tuoreen AML:n hoitoon.
edit: Näyttääkin olevan triplettikokeissa tuore AML testeissä.
Ulkopuolisen tekemä Bex+Pembro-keuhkosyöpäutkimus on peruutettu, ei ehditty ketään rekrytä, IRB (Institutional Review Board) lakkautti tutkimuksen 15. toukokuuta 2023. IRB on tutkimuseettinen toimikunta, mikä on kaikissa tutkimuksissa varmistamassa mm. eettisyyttä. Faron on ilmoittanut tutkimuksen päävastuulliselle tutkijalle (PI), että vaiheen II koevaihe on saanut FDA:n (Yhdysvaltain elintarvike- ja lääkeviranomaisen) hyväksynnän jatkamiseen. Tämä peruttu oli faasi 1.
Tämä on uutinen. Olikin kummallisuus, Faronilla omat suunnitelmat keuhkosyövän kombotutkimuksesta, MATINSista runsaasti uutta dataa tuli tämän tutkimuksen suunnittelun jälkeen, joten uusiksi menee. Pääsisi suoraan faasi kakkoseen?!!
Tämä on San Antonion maksama tutkimus, joten Faron ei ole tahtipuikossa kiinni ja siten voi olla vaikea viestiä kaikkea, mutta voisi kyllä lupaa kysyä ja viestiä, tuleeko sitten faasi 2.
Mielenkiintoista. Ihmettelinkin hieman viimeksi, kun katsoin tuon päivitetyn pipeline sivuston, miksi Bexcombo oli merkitty faasin I loppuun, Clinical Pipeline | Faron. Iso uutinen, jos nuo kombinaatiokokeet päästään aloittamaan jo suoraan faasista II.
Julkisuutta Britanniassa:
Foorumilla on ollut paljon keskustelua Gileadista & Forty Sevenistä. Alla mielenkiintoinen tiedote liittyen aiheeseen.
Vaiko syy Gileadille alkaa etsimään vaihotehtoisiä lääkkeitä anti-CD47 vasta-aineiden tilalle tai oheen kombinaatioksi? En tiedä olenko tarpeettoman härkäinen tämän keissin suhteen, mutta ennemmin näen tämän isommille firmoille syynä alkaa kohta kilpailemaan siitä kuka saa ostaa Faronin markkinoilta. Magrolimabin ja Bexin toimintamekanismit ovat kuitenkin hyvin erilaiset ja siinä missä anti-CD47 saattaa epäonnistua voi anti-Clever-1 hyvinkin toimia.
Eikös tuo Magrolimab ollut noissa kokeissa ensimmäisenä hoitona, ja Bexiä taas testataan niillä joilla mikään ei ole toiminut?
Ei kyllä kuumottele yhtään, päinvastoin.
Faronilla on erinomaiset tulokset juuri MDS:stä. Siitä voi spekuloida, mitä siitä seuraa…
Levitetään tässä Lontoon porukan löytöjä Clinical Trial Arenasta:
Aiemman Gilead jutun lisäksi siellä:
Bexmab - uusia saitteja
United States, Texas
The University of Texas Health Science Center at San Antonio
San Antonio, Texas, United States, 78229-3901
Finland
Clinical Research Institute HUCH Ltd
Helsinki, Finland, 00290
Oulu University Hospital
Oulu, Finland, 90220
Tampere University Hospital
Tampere, Finland, 33520
Turku University Hospital
Turku, Finland, 20520
France
The Institut Gustave Roussy
Villejuif, France, 94805
Netherlands
Erasmus University Medical Center Rotterdam
Rotterdam, Netherlands, 3015 GD
Spain
START Madrid - CIOCC Hospital HM Sanchinarro
Madrid, Spain, 28050
United Kingdom
The Royal Marsden NHS Foundation Trust
Sutton, Surrey, United Kingdom, SM2 5PT
Queen Elizabeth Hospital Birmingham
Birmingham, United Kingdom, B15 2GW
The Christie NHS Foundation Trust
Manchester, United Kingdom, M20 4BX
Tuo Clinical Trialsin linkki on Matinsin kokeisiin. Bexambin numero on tämä NCT05428969. Tuohon ei ole ainakaan vielä merkitty uusia saitteja Bexmabiin Suomen saittien ja Teksasin ja Kalifornian saittien lisäksi.