Mielenkiintoista mitä ESMO 2023:ssa esiteltävä Matins full data analysis sisältää. Huomio on pyörinyt enimmäkseen BEXMABin ympärillä. Matinisissa kuitenkin on ollut vasteita joissakin indikaatioissa, josko olisivat pitkäkestoisia vasteita noilla last-line-all-soc-tried tapauksilla.
Faronin Esmo posteri abstrakti on tullut julkiseksi viime yönä. tldr; A dose of 1mg/kg Q3W is considered feasible for further monotherapy studies in solid tumors.
Muuten ei mitään mitä ei oikeastaan tiedettäisiin jo. btw tässä oli ne 214 potilasta mitä täällä on peräänkuulutettu. Onhan tälläkin jo useita satoja potilaita mittarissa. ![]() Ja ihan kohtuullinen elossaolon pidennyt näyttäisi olevan tullut noille jotka on vastanneet hoitoihin.
Ja ihan kohtuullinen elossaolon pidennyt näyttäisi olevan tullut noille jotka on vastanneet hoitoihin.
https://cslide.ctimeetingtech.com/esmo2023/attendee/confcal_2/presentation/list?q=bexmarilimab
Background
Clever-1 is an immunosuppressive scavenger receptor expressed on tumor associated macrophages. Bexmarilimab (FP-1305) is a novel humanized anti-CLEVER-1 IgG4-antibody capable of switching tumor macrophage phenotype leading to T-cell mediated anti-tumor responses.
Methods
MATINS (Macrophage Antibody To INhibit immune Suppression) trial is a first-in-human phase I/II study (NCT03733990) to assess safety and preliminary efficacy of Bexmarilimab (Bex) in patients with refractory advanced solid tumours. Part I has been completed with initial adequate safety profile, preliminary signs of efficacy, and initial recommended dose of 1mg/kg Q3W for part II. In Part II, 10 patients with distinct solid tumour types and variable doses and dosing frequency of Bex were studied to investigate safety, tolerability and efficacy.
Results
At the data cut-off of Apr 17th 2023, 214 patients have been enrolled to the study. In the alternative dosing cohorts, 66 patients were exposed to Bex with 1-3mg/kg Q1W, 1-3mg/kg Q2W, or 3-30mg/kg Q3W dosing. Bex was well tolerated with fatigue (15.9%) and pyrexia (5.6%) being the most frequent treatment related adverse event (TRAE) and 7.9% of the patients experiencing grade 3-4 TRAE. Disease control rate (DCR) was 13.0% (n=28) overall. Highest disease control rates (DCR) were observed in hepatocellular cancer (36%), ER+ breast cancer (33%), cutaneous melanoma (22%), and cholangiocarcinoma (21%). DCR was associated with Bex-induced immune activation in blood and tumor. Median progression-free survival was 2.0 and overall survival 5.6 months. 18-month survival rates (landmark analysis) were 32.9% in patients achieving DCR while this was 5.5% in non-DCR patients. The PFS ratio (defined by the PFS on bex/duration of previous treatment line) was > 1.3 in 46.4% of the DCR patients while this was 9.6% in non-DCR patients (p<0.0001). In the alternative dosing regimens, no dose-dependency was observed to adverse events or DCR rates.
Conclusions
Bexmarilimab demonstrates promising anti-tumour activity as a monotherapy in several refractory solid tumours. A dose of 1mg/kg Q3W is considered feasible for further monotherapy studies in solid tumors.
Clinical trial identification
NCT03733990.
Legal entity responsible for the study
Faron Pharmaceuticals.
Funding
Faron Pharmaceuticals.
Päivitin vähän tätä mun miellekarttaa, tosiaanhan markku taisi tässä jossain näästä haastiksista mainita että seuraava setti bexmab dataa julkaistaan ASH:ssa johon heillä on posteri jo hyväksyttynä.
Kurssi on painunut taas viimeaikoina niin omituisesti hyviin uutisiin että olisko se syyskuulle luvattu anti nyt sitten tuloillaan.
Ehdin elää luulossa, että nyt tulee biomarkkeridata, koska muut tuloksethan olivat pitkälti tuttuja. Oliko tuo monoterapian suositusannos nyt uutta? Posterin merkkimääräkö oli rajoitteena, joten ”kirjan takakansiteksti” vain mahtui? Tuossa sanottiin nyt vain immunoaktivaatio, tarkentamatta. In blood tarkoittanee interferon gammaa? Muuta? In tumor? T-solumäärä? Clever-pitoisuuttahan ei enää seurattu. Ehkä siellä posterin parissa verbaalinen selitys on laajempaa, saisivat kyllä kirjoittaakin asiasta vielä ja kuka tietää.
Mielenkiintoisen lisän tuo ehkä jatkossa:
Faronin Inka (joka oli viime showssa Markun kanssa) näyttää LinkedInissä tykänneen satojen muiden muun alan ihmisten kanssa postauksesta, jossa käsitellään immunologisten syöpälääkkeiden hoitovasteiden arvioinnin haasteita. OS eli elossaoloaika sen sijaan on helppo, on tai ei ole hengissä.
Kiinteissä kasvaimissa (kuten MATINS, BEXCOMBO, BEXLUNG) perinteisten kasvaimen kuvantamisesta saatujen mittaustulosten (recist) on havaittu olevan ongelma, koska kasvain voi jopa suurentua, vaikka syöpäsolut vähenevät tai se ei pienene, koska kasvaimen ympäristön tulehdus-/sidekudossolut voivat muodostaa syöpäsolujen sijaan suurimman osan näkyvästä möykystä. Metastaasit voivat olla jo kohteessaan ja turha enää kuvantaa primaarikasvainta. Kasvain voi kroonistua, mutta elämä jatkuu.
Niinpä tarvittaisiin nopeampia ja validimpia mittareita vasteille. Yksi on pelkkään verikokeeseen perustuva on veressä kiertävän kasvaimen DNA:n (ctDNA) mittaus. Postaus tukeutuu viikko sitten julkaistuun Nature Medicinen artikkeliin
https://www.nature.com/articles/s41591-023-02598-9
Tuossa käsitellään asetelmaa, jossa on ”BEXLUNG tai BEXCOMBO” ilman Bexiä eli ei-pienisoluinen keuhkosyöpä, jota hoidetaan pembrolla.
”Several proof-of-concept studies have indicated that the optimal timepoint for ctDNA response (mR eli molecular response) lies between 4 weeks and 9 weeks from single-agent immune checkpoint blockade initiation (after two cycles of pembrolizumab)”
”Median time to ctDNA response was 2.1 months (90% CI: 1.5-2.6), and patients with mR attained longer progression-free survival (5.03 months versus 2.6 months) and overall survival (not reached versus 7.23 months).”
”ctDNA molecular response, defined as complete clearance of circulating tumor load after two cycles of pembrolizumab, was largely concordant with radiographic response assessments but, notably, was more informative in predicting OS.”
”An increasing number of studies support the role of ctDNA molecular response as an early endpoint of therapeutic response”
”radiographic imaging may fail to timely detect the magnitude of therapeutic response for patients with stable disease, and ctDNA response may be of particular value in assessing therapeutic response in this setting.”
Tätä ctDNA-mittausta voidaan tehdä ”reaaliaikaisesti”, vähän kuin BEXMABissa. Jos näyttää siltä, että annettu hoito ei enää toimi, vaihdetaan/lisätään lääkkeitä. Hoito voisi tehostua, trialit nopeutua, hyväksyntä nopeutua. Skene on hidasta muuttumaan, mutta lähitulevaisuutta tämä varmaan on. Clinical Trials antaa yli 500 hakutulosta faasi 2 ja 3 tutkimuksille, joissa on ctDNA osana.
Olisikohan pakkasessa näytteitä, joista voisivat tätä MATINSistakin tutkia?
Ehdin elää luulossa, että nyt tulee biomarkkeridata, koska muut tuloksethan olivat pitkälti tuttuja. Oliko tuo monoterapian suositusannos nyt uutta? Posterin merkkimääräkö oli rajoitteena, joten ”kirjan takakansiteksti” vain mahtui? Tuossa sanottiin nyt vain immunoaktivaatio, tarkentamatta. In blood tarkoittanee interferon gammaa? Muuta? In tumor? T-solumäärä? Clever-pitoisuuttahan ei enää seurattu. Ehkä siellä posterin parissa verbaalinen selitys on laajempaa, saisivat kyllä kirjoittaakin asiasta vielä ja kuka tietää.
Vähän pidemmän aikaa tätä kun olen pureskellut niin tossa on tosiaan mun muistikuvan mukaan kaksi uutta asiaa.
-
Annostelu on nyt varmistettu että se on 1mg/kg - tän suhteen on ollut paljon epävarmuutta, ylimääräisiä kohortteja jne joten hyvä että se on nyt selvä. Jos ne kirjoittaa sen noin varmasti tieteelliseen julkaisuun niin uskoisin että heillä on myös FDA:n kanssa tästä yhteisymmärrys.
-
Potilaita on nyt seurattu huomattavasti pidempään, joten elossaolon hyöty on myös saatu laskettua selvästi pidemmällä otannalla.
The PFS ratio (defined by the PFS on bex/duration of previous treatment line) was > 1.3 in 46.4% of the DCR patients while this was 9.6% in non-DCR patients (p<0.0001).
Metodologisesti jos miettii niin tätä parempaa dataa ei tällä populaatiolla ja tutkimustavalla taida saadakkaan kun ei tässä missään vaiheessa ollut tarkoituskaan saada tyhjentävää vastausta siihen että elääkö potilaat bexillä pidempään vai ei. Katotaan ne sitten randomoiduissa myöhemmissä kokeissa.
Oon sanonut tän ennenkin, ja toistan sen uudestaan että näistä tuloksista tää ER+ breast cancer (33%) on kyllä mielenkiintoinen, ja valitettavan vähän huomiota saanut indikaatio. Se on valtavan iso ja täysin nykyisten immunoterapioiden ulkopuolella. Valtava potentiaali ja ihan jo akateemisesta mielenkiinnosta haluaisin tietää lisää tosta joukosta.
Biomarkkeridata hmm…MATINS-arkeologi löysi
ESMO 2019 Bono: https://oncologypro.esmo.org/meeting-resources/esmo-2019-congress/Immune-activation-with-a-novel-immune-switch-anti-macrophage-antibody-anti-Clever-1-mAb-FP-1305-in-phase-I-II-first-in-human-MATINS-trial-in-patients-with-advanced-solid-tumors Initial FP-1305 dosing led to an increase in blood NK cells (median 154 %), CD8+/CD4+ T cell ratio (median 121 %), B cells (median 143 %) and a decrease in regulatory T cells (median 65 % from baseline).
Joulukuu 2019 Clevegen downregulates a range of major immuno-oncology (IO) checkpoints in MATINS cancer patients Biomarker analysis could guide future combination therapies with Clevegen - PharmiWeb.com ”First available set of cell surface biomarker data from a group of seven patients to be presented at the congress show that: 1) anti-Clever-1 treatment in cancer patients decreases a broad range of checkpoints including PD-1, PD-L1, CTLA-4, OX40, 41BB, LAG3 and 2) co-stimulation markers CD28 and ICOS on circulating T cell populations whereas 3) it increases the expression of activation markers CD25 (IL-2RA), CXCR3 and CD69. In addition, anti-tumour responses with anti-Clever-1 treatment are found to associate with an increase in plasma interferon gamma (IFN-gamma), which is one of the tools the immune system is using to fight against cancer.”
Syyskuu 2020 artikkeli, jossa Bono ja ihan oikeat HUSin syöpälääkärit mukana
https://www.annalsofoncology.org/article/S0923-7534(20)41140-8/fulltext
”Peripheral increase in NK cells, CD4+, CD8+, CD8+/CD4+ T cells ratio, B cells and a decrease in regulatory T cells was observed after FP-1305 dosing. Also at least a 20 % increase of systemic IFNγ in 40 % of patients and CXCL10 in 33 % of patients was observed. FP-1305 dosing led to activation (CD25+) and Th1 skewing (CXCR3+) of T cell populations including increase in effector CD8 T-cell population with downregulation of several inhibitory immune checkpoint molecules (PD-1, PD-L1, CTLA-4 and LAG3).”
2021 joulukuu https://www.prnewswire.com/news-releases/faron-announces-topline-matins-biomarker-analysis-301440951.html”The initial biomarker data shows patients with low interferon gamma (IFNg) and tumor necrosis factor alpha (TNFa) levels experienced significantly higher clinical benefit (defined as partial response or stable disease) following treatment with bexmarilimab. The biomarker analysis included the first three cohorts of special interest from the trial: cutaneous melanoma, gastric cancer, and cholangiocarcinoma.
Among the 30 patients included in the analysis, all of whom were heavily pre-treated, and PD-1 blockade refractory/resistant, nine experienced clinical benefit and 21 did not following treatment with bexmarilimab monotherapy. At baseline, the nine patients who experienced clinical benefit had significantly lower serum IFNg (P = 0.03) and TNFa (P = 0.005) levels compared to patients that did not experience clinical benefit. Additionally, a more than 100% increase in IFNg levels was seen after the first cycle of bexmarilimab treatment among patients who experienced clinical benefit.”
ASCO 2022 jälleen pätevät ulkopuoliset mukana https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.2645
”Preliminary biomarker analysis (n = 77) demonstrated positive trend (p = 0.038) between CBR and higher intratumoral Clever-1 positivity (median of 15% positivity (range 0-25) in CBR and 3% (range 0-85) in non-CBR patients)”
Onhan tossa dataa. Ei ilmeisesti sitten saatu enää uutta irti, tosin viime vuonna vielä lukee, että ”Preliminary biomarker analysis demonstrated”. Onko sitten niin, että koko aineistossa ei sitten CLEVER-1 näyte kasvaimen sisältä enää ollut tilastollisesti merkitsevä? Vai pantataanko sitä final analysista?
Wainwrightin syyskuu 2023
https://journey.ct.events/view/49b57636-a343-4751-a341-05413214441c kohdassa 20:30 haastattelija kysyy, mitä biomarkkereita Faron aikoo käyttää potilaiden valinnassa Bex-hoitoon?
Markku vastaa, että Interferon signature, CLEVER-1-pitoisuus, PD-L1. Jatkaa:
Now having the data of intratumoral conversion from M2 to M1, which of those signaling pathways are critical to obtain that immunoactivation. I cant reveal all of that.
Markkumainen cliffhangeri taas. Tuon takia elin uskossa ![]() , että josko sitä dataa tulee. Voi tietty olla, ettei mitenkään liity MATINSiin, mutta sieltä suurin kliinisen ympäriston data on.
, että josko sitä dataa tulee. Voi tietty olla, ettei mitenkään liity MATINSiin, mutta sieltä suurin kliinisen ympäriston data on.
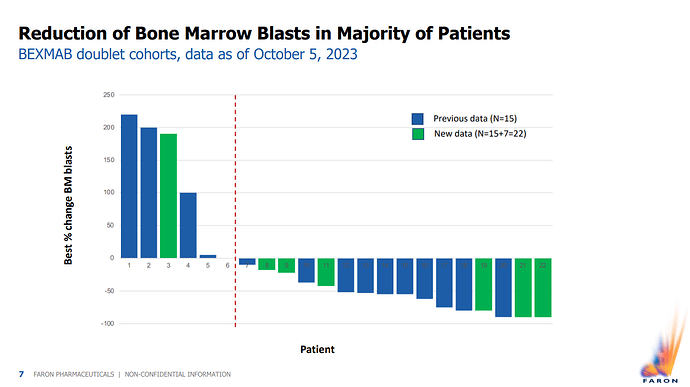
Tuosta kun katsoo uudet vasteet verraten syyskuun corporate deckiin, niin nämä 3 uutta responssia näyttäisi tulleen 3 mg ryhmässä ja 2 näistä oli MDS ja yksi MDS-HMA.
Uusia potilaitahan oli 7 yhteensä. Onko jossain olemassa dataa, mitä annoksia ja syöpiä nämä 4 muuta potilasta saivat/sairastivat?
Onko nyt niin, ettei vielä ole annettu 6 mg lainkaan noille lisäpotilaille (aiemmin tuli parhaat tulokset sillä) ja oliko lisäpotilaissa r/r AML:ää useallakin, joissa vasteet on pienempiä kuin MDS/MDS-HMA:ssa?
Olisi mielenkiintoista tietää nämä, koska varsinkin hoitoannoksen määrällä näyttäisi olevan vaikutusta lopputulokseen.
MJ: Well, this has been a dose escalation part of the study. Initially, we didn’t know what the optimal dosing would be. As we increased the dosage, we learned that higher doses provide better efficacy and better objective response rates.
Among the seven additional patients we included in this readout, six showed a decline in cancer cells, and five had an objective response. Altogether, we had 22 patients, and 50% showed a decrease in pre-cancer blasts. This is significant because normally, this rate would be less than 10%.
Markku mainitsee tuossa haastattelussa, 5 sai vasteen näistä uusista 7 potilaasta. Tiedotteessa oli muistaakseni vain 3 lisäpotilasta aiempaan nähden, jotka olivat remissiossa. Onko asiat edenneet sitten datan lukemisen vai mitä en ole tuosta ymmärtänyt? No, 5/7 vastetta on parempi kuin 3/7 ![]() .
.
Tosiaankin vasteet näyttäisivät olevan parempia isommilla annoksilla.
En tiedä onko kyseessä eritasoiset vasteet sitten mistä ollut puhe. Tämä slide, jossa luuytimen blastien määrä on esitetty, on ainoa tuossa esityksessä missä on kaikki 22 potilasta. Näistä uusista 3/7 on saavuttanut yli 50% vähennyksen blastien määrässä ja 6/7 ylipäätään vähentynyt. En tiedä mitä tasoa sitten käytetään rajana OR:lle, vai lasketaanko siihen muitakin tekijöitä.
Markku tuossa tosiaan kertoo/kertaa, että nyt saaduissa suurempien annosten tuloksissa on havaittu suurempi teho, paremmat hoitovasteet. Seitsemästä uudesta potilaasta (22-15=7), jotka tulivat nyt luentaan, joilla siis 2 tai enemmän hoitokuukausia, kuudella blastit vähenivät ja viidellä oli hoitovasteeksi luettava blastien vähenemä.*
Kaikista BEXMABiin osallistuneista 50 %:lla blastien vähenemä**, kun SoC:lla se olisi alle 10 %.***
*PR:ksi yleensä määritellään blastien vähentyminen ainakin 50 prosenttia alkuperäisestä tasostaan, AML:ssä lisäksi ei saa olla jäljellä yli 25 %. Tuossa näyttää olevan mukana HI eli veriarvojen parantuminen kahdella tutkittavalla yli 2 kk:n kohdan luennassa.
** Näyttäisi olevan myös kaikilla 11/22 potilaalla eli 50 %:lla myös blastien osuuden vähenemä 50 % tai enemmän =vähintään PR, kaikkiaan 16/22 potilaalla ne jossakin vaiheessa ovat vähentyneet edes jonkin verran.
***heavy userille suota tarvottavaksi ennusteeseen vaikuttavista tekijöistä ja lääketutkimuksista Cancers | Free Full-Text | What’s Next after Hypomethylating Agents Failure in Myeloid Neoplasms? A Rational Approach. Mihin verrataan, on hitokseen väliä. Löytääkö joku lähteen tuolle ”less than 10 % normally”?
Hyvä, jos azaa aiemmin käyttämättömät MDS:t ja AML:t jää pois sotkemasta tuloksia jatkossa.
Edit korjattu PR blastit kriteeri
Lontoon puolelta copsattu:
Jutun pääosa jää maksumuurin taa.
Laittaisitko jonkun referoinnin tuosta jos postaat pelkän linkin, ei oikein tuo mitään informaatiota monille ketjun seuraajille kun juttu on maksumuurin takana, kiitos.
Hieno homma että tutkitaan ja tutkitaan, kerätään rahaa ja tutkitaan.Pitäisi vaan jossain kohtaa päättää että nyt ollaan tarpeeksi tutkittu ja palkita sijoittajat kovalla arvonnousulla, tai kohta ei tutkita enää kuin taskun pohjia.Nimittäin kun ollaan pörssiin tultu, niin täytyy pitää huolta myös osakkeenomistajien rahoista.
Sperakartio
Tietysti tyhjiä sanoja, jotka tulevat oletetun osakkeenomistajan tahdosta tehdä rahaa?
“Tehkää mitä teette mutta haluan jo voittoni”
Lauseessasi oli se totuuden siemen, että tämähän heidän pyrkimys on, mutta täytyy muistaa ei ne sitä nimenomaan sinulle tee.
Prosessissa on vaiheet ja käsittääkseni ovat aikatauluaankin raottanut pitkin vuotta että 2025 myyntilupahakemus vetämään (huom hakemus).
Partnerointi kaiken onnistuessa luulisi tapahtuvan ennen sitä, mutta täytyy muistaa, että ostajan miljardit painavat heillä vaakakupissa ja riskianalyysit pitää tehdä. Jos sijoitit tähän voit hävitä kaiken kuukauden päästä jos lääke yhtäkkiä muuttaakin kaikki sen saaneet perunoiksi.
Tosin jos kaikki menee hyvin sinulla on karkea arvio annettu milloin sopisi odottaa asioiden tapahtuvan.
Käsittääkseni tälle vuodelle ei ole kukaan luvannut kuin lisää tutkimusdataa. Nyt ollaan dose escalation vaiheen häntäpäässä vasta ja vaikka data on hienoa ja hyvää ei sitä voi purkittaa ennen kuin esteet ja radat on juostu läpi.
Ihan oma asiansa sitten jos joku firma tänään haluaisi ostaa Faronin. Saat sitten ääneestää oletetulla äänioikeudellasi kaupan puolesta tai vastaan, mutta jos se nyt tulisi se summa ei liene niin iso kuin vuoden päästä isommalla datasetillä.
Lontoon puolella keskustelu välillä äityy vähän liiakseen tasolle “äh olisi kiva jos jotain tapahtuisi”. No niin varmaan olisi, mutta ei sitä ähkimällä paranneta. Osakkeen väliaikainen hintakin ennen lopullista tuomiota on täysin epärelevantti ellei hae päivittäisiä pikavoittoja (näemmä siihen Faronin osake on historiallisesti ollut ihan jees jos ei suurilla summilla pelaa)
Tunnetusti en anna sijoitusneuvoja. Tämäkään ei ole sellainen
“Me olemme lääkekehitysyhtiö. Me teemme isoa tappiota. Me emme jaa osinkoa. Me myymme lupausta huomisesta.”, vai mitä se Juho sanoikaan.
Kannattaa pitää katse 2025:ssa. Faron kuluttaa rahaa tutkimuksiin ja sitä rahaa saadaan joko omistajilta tai partnereitla. Jos lääkeaihio myydään hätäisesti ja liian aikaisin, ei siitä saada maksimoitua omistaja-arvoa. Tämä arvo syntyy kokeiden tulosten perusteella. Kurssi heittelee näiden tulospäivitysten välillä. Tällä hetkellä varmaan lasketaan seuraavaa antia kohden, kunnes se varmistuu. Bexmabin seuraava päivitys vasta joulukuussa. Jos ei jaksa odottaa kokeiden valmistumista, niin laput voi aina myydä markkinoilla. Tänään ostajia näyttäisi olevan 3,37 € paikkeilla.