Positiivisia uutisia Clevegeniin liittyen:
toivotavasti traumakinen autaa estämään tämän että tulokset on positiivisia. ja tässä voisi olla faronin seuraavaa lääke kehitys idea tähän keuhkofibroosiin hoitava lääke, koska ymmärtääkseni elinajan odote on 3-5v keuhkofibroosissa (jos etenevä).
Olen nyt tehnyt pari pientä Farnon lisäostoa nyt kesäkuussa lähinnä sillä ajatuksella, että R&D webcastia tuskin järjestettäisiin, jos yhtiöllä olisi huonoja uutisia. Toisesta lisäostoksesta tein päätöksen eilen illalla ja positiivinen tiedote tänä aamuna sinetöi sen. Luin vähän tuosta apurahasta ja Faron on saamassa* max €2.5m apurahan. Mielenkiintoista oli lukea myös, että tuettavien projektien pitäisi olla valmiina 12-24kk kuluessa.
*EDIT: korjasin saanut muotoon saamassa niin pysytään paremmin totuudessa. Vahvistusta vaille vielä tämä summa.
Vähitellen se kurssi painuu tuon 4,00€ antihinnan alapuolelle. Anti kuitenkin merkattiin yli reilusti ![]() .
.
Toki tämä tuntuu luonnolliselta, sillä varmasti osa omistajista hyppäsi kelkkaan mukaan maaliskuun hyvien uutisten mukana ja ovat nyt ns. pettyneet, kun kurssi ei ole noussut minnekään.
Pahoittelut jos menee off-topiciksi, mutta eipä tästä firmasta muutakaan ole tällä hetkellä sanottavissa ![]() .
.
Ei huolta, alamäen jälkeen tulee aina ylämäki😂
Tiistaina saadaan varmaan tietoa näistä?
-FDA fast track
-Faasi 2 alustavia tuloksia
-Traumakine solidarity trial alustavia tuloksia
-clevegenin myynti miljardilla isolle jenkki firmalle😂
Nyt tuli niin paljon tiukkaa faktaa, että oli pakko tehdä lisäostoa entisten seuraksi. Nyt ei muuta kuin odottamaan ensi tiistaita. ![]()
Olen yrittänyt kesäkuun aikana arvioida Faronia, niillä tiedoilla mitä olen Googlen avulla löytänyt. Sijoitin jopa euron Arvopaperilehden tutustumistarjoukseen ![]() Lehdessä oli nimittäin juttu, kuinka sijoittaa pörssiin tuleviin pieniin lääkekehittäjiin.
Lehdessä oli nimittäin juttu, kuinka sijoittaa pörssiin tuleviin pieniin lääkekehittäjiin.
Tässä muutama kysymys, jotka artikkeli nosti esiin.
-
”Millainen sijoittajakunta yhtiössä on? Onko osakaskunnassa farmaan erikoistuneita rahastoja? ’Peesausstrategia’ ei ole lainkaan huono”, opastaa Laine.
-
Toinen syynättävä asia on johtoryhmä. ”Onko siellä kansainvälisiä arvovaltaisia tahoja? Jos on pelkkiä härmäläisiä, laittaisin kysymysmerkin.”
-
Seuraavaksi kannattaa arvioida yhtiön rahoitusta. Jos yhtiö lupaa seuraavan kehitysvaiheen tuloksia vuoden päästä, kassan pitää riittää sinne, ja puskuria kannattaa olla viiveitä varten. Muuten edessä voi olla uusia anteja ja lainoja, ja niiden myötä omistuksen arvo liudentuu.
-
Syytä on myös perehtyä yhtiön tiedottamiskulttuuriin: riskien arviointiin ja mahdollisista viiveistä ilmoittamiseen.
Kolmoskohtaa on maalikkona vaikea arvioida, mutta Farnoniin on nyt sijoittanut ainakin ruotsalainen eläkesäästöfirma, johtoryhmässä on kansanvälistä ja kokenutta porukkaa. Faronilta on mielestäni tullut ihan kivasti myös yritykseen liittyviä tiedotuksia.
Löysin myös Danskepankin sijoutuslehdestä lääkesijoittamisesta artikkelin, jossa sanottiin, että “Lääkkeen kehitystyöhön alusta markkinoille tuloon asti saattaa hyvinkin kulua 2,5 miljardia dollaria. Summaan sisältyvät myös niiden lääkkeiden tutkimuskustannukset, jotka eivät koskaan pääse laboratoriota pidemmälle.” Kuinka paljon Faronilla on siis vielä edessä tutkimustyötä, ennenkuin päästään markkinoille on itselleni ainakin vielä arvoitus ja riittävätkö kassassa olevat miljoonat jäljellä olevaan tutkimustyöhön? ![]()
Samaisessa Danskepankin lehdessä pohdittiin lääketeollisuuden graalin maljoja:
”Jos jokin lääkeyhtiö pystyy muuttamaan syövän krooniseksi sairaudeksi tappavan sijaan, keskimääräinen elinikä pitenee merkittävästi…" Ei ehkä ollut sattumaa, että toukokuun loppupuolella olleessa lehtiartikkelissa Faronista oli nostettu Markun lause ”Jos onnistumme, syöpäkin voi olla vain krooninen sairaus” jutun pääotsikoksi. Odotukset Clevegenin suhteen ovat ainakin korkealla.
Itse ainakin toivoisin, että Faronia ei myytäisi pois vaan Faron tuottaisi yhteisöveroa Suomelle vuosikymmeniä ja Jalkasten säätiö saisi kanavoitua tuloja lääkekehitykseen, kuten toivovat. Muuten ei mitään kommentoitavaa @kuhaLottoon pohdintaan.
Tässä vielä linkki Danskepankin lehteen, josta oli itselleni ainakin paljon uutta.
Google löysi Interferon beta-1a hakusanalla tuoreen tutkimuksen ReciGen lääkkeestä, joka on ilmeisesti myös Traumakinen tapaan Interferon beta-1a tyyppinen lääke. Jos tulkitsin oikein niin 28 päivän seurannassa nähtiin merkittävä väheneminen kuolleisuudessa potilailla, jotka saivat Interferon beta-1a lääkettä verrokkiryhmään verrattuna. Liitin koko tutkimuksen tähän postaukseen mukaan, jos joku haluaa sitä lukea. Pieni yhteenveto on myös täällä
2020.05.28.20116467v1.full.pdf (318,1 Kt)
Jalkasen perhe on myös julkaissut 12.6.2020 artikkelin
Conclusions
IFN-beta is now among the leading candidates to treat COVID-19 in various clinical trials, and i.v. and s.c. routes of administration are considered to be equal. This is not the case due to the different bioavailabilities of IFN-beta via i.v. and s.c. injections in target organs. This aspect needs to be taken seriously, when critically ill patients with compromised peripheral circulation are treated.
Saas nähdä onko tiistaina juttua enemmän Clevegenistä vai Traumakinesta.
Faron receives EUR 2.1 million funding from BF
15.6.202009:00
Faron Pharmaceuticals Oy
(“Faron” or the “Company”)
Faron receives €2.1 million funding from Business Finland for Traumakine manufacturing
Company announcement, 15 June 2020 at 9.00 AM (EET)
Insider information
TURKU - FINLAND - Faron Pharmaceuticals Oy (AIM: FARN, First North: FARON), the clinical stage biopharmaceutical company, today announces plans to initiate a new state of the art process for the manufacturing of interferon (IFN) beta-1a. To support this, Faron has received a €2,100,000 low interest rate loan from Business Finland, the governmental innovation financing agency of Finland (“Loan”). The Loan funds will be used to develop and select a new cell line that can be used for future commercial scale production of Faron’s human IFN beta-1a.
Alkavat valmistamaan uutta Traumakinea, hyvä indikaattori.![]()
Tässähän on vielä kuulematta mikä ratkaisu tulee siihen “riitaan” Traumakinen aiemman valmistajan kanssa. Hyvällä tuurilla Faron saa vielä kompensaatiota sieltä päin. Massia kassaan ![]()
EDIT (lisätty linkki):
As a remedy, the Company has filed a request for arbitration with the Arbitration Institute of the Stockholm Chamber of Commerce seeking damages. To fund the proceedings, the Company has entered into a litigation funding agreement with a third-party recovery services provider offering non-recourse financing which, subject to final quantum, is expected to cover both the Company’s legal expenses and the adverse party costs. The funder would receive a typical portion of any damages awarded in the event of success.
Tässä taas aika tuore artikkeli. Interferon α/β lääkkeitä on kokeiltu suurehkolle potilasmääräälle (verrattuna muihin lääkkeisiin) ja tulosten perusteella ihan hyvästä syystä sillä Interferon α/β saaneilla on ollut nopein hoitovaste lääkkeelle. Suurin osa aineiston potilaista on kiinalaisia eli kyseessä on Kiinassa tehdyt tutkimukset. Tällä tuskin on merkitystä, mietin vaan onko Traumakinea ollut sielä kuitenkaan käytössä. Kyseessä on saattanut olla jokin toinen interferon α/β lääkevalmiste.
Alkaa olla ehkä tilanne, missä Faronin Interferonin osaamisella on merkittävästi laajempi arvo ja käyttömahdollisuudet. Uuden tuotantoprosessin kehittäminen [to initiate a new state of the art process for the manufacturing of interferon beta-1a] ja tuotantokapasiteettien ylösajo (vaikka kumppaneiden kautta) on selvästi uudella potentiaalilla verrattuna ennen COVID-19 aikaa. Sen lisäksi on paljon tutkimuksia julkaistu Interferon / IFN beta-1a käyttöön muiden sairauden osalta. Eli aineen olisi varmasti kasvava kysyntä.
Interferoneille on kasvava kysyntä ja Faronin IV osaaminen, myös ehkä tuotantomenettelemiin liittyvät innovaatiot ovat asiaa.
Traumakinen ja IFN potentiaalia ei ole ehkä nyt osakehintaan laskettu lähes lainkaan.
Huomenna illalla ollaan taas viisaimpia.
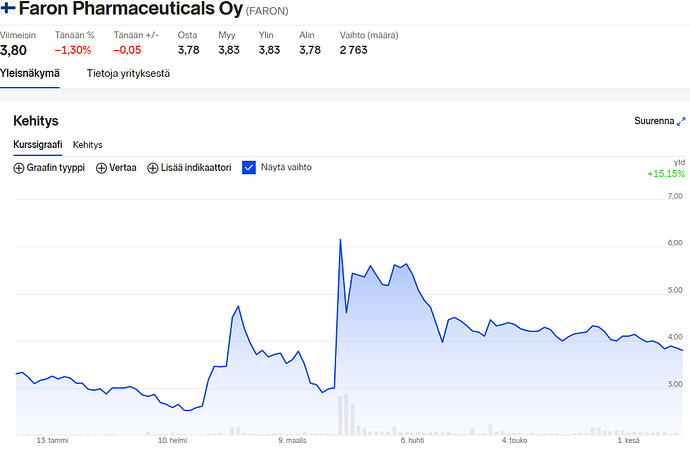
Oman salkun puolesta toivon näin. Tänään kurssi nousi aavistuksen plussalle Lontoossa. Mulla on mielessä se, että Faron oli £9 hujakoilla parisen vuotta sitten ilman Clevegen lääkettä (tai ainakaan se ei ollut yhtä pitkällä) ja ilman COVID-19 tapauksia. Nyt kurssi on kuitenkin alle puolet siitä. Eli olen miettinyt onko Faronin etumatka/kilpailuetu on vähentynyt toisiin laakevalmistajiin verrattuna (en tiedä ketkä ovat kilpailijoita)?
Kummankin lääkkeen kaupallistaminen on kaukana tulevaisuudessa tai sitten markkinat ovat hinnoitelleet tämän pahasti alakanttiin?
Vielä ei ole tullut lisätietoa R&D tapahtumaan liittyen. Tarkoitus olisi olla kuulolla.
On ylipainoittettu minullakin, mutta kestän sen hyvin ![]()
Faronin etumatka interferonin osalta on patenttisuojattu, Clevegen on lisäksi JA SE EI OLE VIELÄ KAIKKI.
1bn USD on hyvän teknologian startupin hinta. Nyt puhutaan ICU-lääkkeistä ja vaativasta syöpähoidosta (last chanche drugs), patentoidusta käyttömenetelmästä yhden osalta. Ainoastaan ARDS-keuhkotaudin sairastuvien määrä on seitsemänlukuinen per vuosi, etc.
Nobelin tiedepalkinto on eri asia.
Toiveajattelua, vai rivien välistä lukemista, mutta kivasti voi tulkita tuota Jalkasen kommenttia ”mahdollisesta kysynnän kasvusta”. Kuitenkin sanoo, että varastossa on jo ihan hyvä määrä. Ote tämän päivän Turun Sanomista:
Oikotie markkinoille. Interferonien kysyntä tule huomattavasti kasvamaan.
COVID kautta interferonien rooli ja hyöty on jo ymmärretty laajemmin. Eiköhän tänään kuule lisää.
Jostain syystä tämän aamun RNS ei ole vielä päivittynyt Faronin nettisivuille, joten jaetaan tätä kautta.
Faron Pharmaceuticals Oy
(“Faron” or the “Company”)
Faron provides update on pipeline progress ahead of R&D Day
Company announcement, 16 June 2020 at 9.00 AM (EET)
Inside information
TURKU – FINLAND – Faron Pharmaceuticals Oy (AIM: FARN, First North: FARON), the clinical stage biopharmaceutical company, today provides an update on the progress of its two clinical stage programmes, Clevegen and Traumakine, ahead of the Company’s virtual R&D Day.
Clevegen
Clevegen is Faron’s wholly-owned novel precision cancer immunotherapy, targeting Clever-1 positive tumour associated macrophages (TAMs) in selected metastatic or inoperable solid tumours, currently under development in the ongoing phase I/II MATINS clinical trial. Faron today announces that:
- The World Health Organization (WHO) has approved bexmarilimab as the International Nonproprietary Name (INN) for Clevegen.
- An additional cohort has been added to Part II of the ongoing MATINS trial, exploring the potential of bexmarilimab in patients with anaplastic thyroid cancer, currently without effective treatment. This follows announcement by the Company on 30 March 2020 of the cancer types to be included in Part II of the trial.
- Clinical expansion plans for bexmarilimab will include the investigation of alternative dosing cycles, as pharmacodynamics markers may indicate a need for shorter frequencies, as well as further studies in additional clinical settings.
- Clinical studies are being planned to investigate bexmarilimab in combination with standard of care (SOC) as a first-line therapy in selected advanced solid tumours, and as a standalone neoadjuvant therapy for patients with early stage colon cancer. The Company currently expects patient recruitment for a small number of cohorts to complete around late Q3 with discussions with the FDA to follow in Q4.
Traumakine
Traumakine, Faron’s investigational intravenous (IV) interferon (IFN) beta-1a, is currently under development for the treatment of patients with Acute Respiratory Distress Syndrome (ARDS) and is being used in two global, adaptive trials investigating potential COVID-19 treatments – REMAP-CAP, the Randomized, Embedded, Multifactorial Adaptive Platform rial for Community-Acquired Pneumonia, and the WHO Solidarity trial.
Today the Company announces that a third trial will investigate the potential of Faron’s IV IFN beta-1a to treat COVID-19. HIBISCUS ( H uman I nterferon B eta I n S evere C oronavir US ), will be an investigator initiated study at Harvard Medical School’s Beth Israel Deaconess Medical Center (BIDMC), focused on ICU patients with ARDS caused by viral infection (e.g. COVID-19, influenza). The phase II/III pivotal, randomized, placebo controlled study aims to recruit 350 patients with 1:1 randomization who will be followed for ventilation free dats (VFD) and mortality over the 28 day period post first dosing. No corticosteroid use will be accepted in the study which is expected to enroll patients over 6-8 months throughout the US with many significant hospitals participating. Commencement of the trial remains subject to finalisation of funding arrangements and regulatory approval. Further announcements will be made in due course.
Dr. Markku Jalkanen, Faron’s CEO, said: “We are pleased today to be reporting the continued progress of our two development programmes. Confirming the generic name, bexmarilimab , for our lead immunotherapy is an important milestone for this programme which is rapidly advancing and has shown exciting clinical activity. The positive data seen so far for bexmarilimab gives us the confidence to pursue ambitious future clinical expansion plans for this potential therapy.
“The scientific community is currently focused on discovering new therapeutics to treat COVID-19 and we are very pleased to be supporting these efforts, now with three trials investigating the potential of Traumakine in severely ill patients. We continue to believe in the potential of Traumakine as a future treatment for ARDS and one that could have significant impact on the intensive-care burden from COVID-19. We look forward to providing updates on both development programmes as they progress.”
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) No 596/2014 (“MAR”).
Uskomattoman hienosti kaikki etenee. Traumakinestä tulee vielä iso rahasampo, nyt viimeistään lisään osaketta reilusti.
Tuossa RNS ilmoituksessa laitoin positiivisena merkille, että tutkimus tehdään Amerikan mantereella ja mukana on Harward:in lääketieteellinen osasto. Kansainväliset lääkefirmat seuraavat varmasti tarkasti mitä tuloksia Harward julkaisee ja luultavasti pääsevät tuloksiin käsiksi jopa ennenkuin ne julkaistaan (ehkäpä). Tuossa kyllä sanotaan, että rahoitus on vielä auki ja viranomaisten hyväksyntä tarvitaan myös. Luulisi kyllä, että Harwardin tekemälle tutkimukselle löytyisi rahoittajia, erityisesti kun etsitään lääkehoitoa pandemian suitsimiseen.
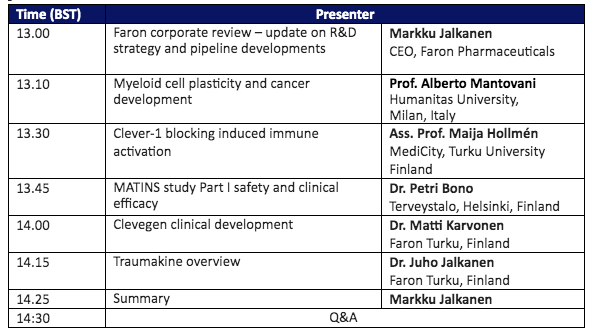
Agenda tämän päivän R&D webcastiin:
Faronilta löytyy nyt Lontoon ja Helsingin lisäksi pörssitunnukset US OTC markkinoilta (FPHAF) ja Berliinistä (4FR). Berliinin listaus oli itselleni uusi löytö. Onko tämäkin merkki siitä, että yrityksellä on vahva luotto tulevaisuuteen, jos kauppapaikkoja on listattu valmiiksi jo useampia? USA ja Berliini kauppapaikoilla ei ymmärrykseni mukaan varsinaista kauppaa vielä käydä.