Tähän on helppo yhtyä. Yhtäläiset kiitokset myös nimimerkeille @Rushimato ja @jerej . Aina on maallikon mukava lukea, kun asioista hyvin perillä olevat keskustelevat.
Nyt kun tietäjiä on paikalla ja vuoden alusta on ennusteltu ja arvuuteltu, niin kysynkin, että jos neuvotteluita tai kiinnostuneita on noinkin monta kuin 20. Voiko olla, että Bex olisi mahdollista myydä syöpätyypeittäin? Jos näin olisi, niin silloin ostajan panostusriski ei olisi niin suuri kuin ostaessa koko Bex potentiaali. Ehkä Bex tulisi paremmin hyödynnettyä. Millään big pharmalla ei taida laaja-alaisesti olla lääkettä kaikkiin syöpätyyppeihin, vai onko? Pikku myynneistä ja rojalteista voi tulla isompi summa kuin kertapottina. Tässä näin mielikuvitusleikkinä.
Big pharmalla on yleisesti ottaen liikaa rahaa ja ne etsii mielummin pienemmän riskin miljardiluokan ostettavaa, kuin pieniä epävarmoja kymmenen-parin sadan miljoonan panostuksia.
Tästä saa vähän kuvaa heidän ajattelutavastaan ![]() . Siellä etsitään tulevaisuuden kassavirtaa ja Faron kokonaisuudessaankin on vähän pieni ja aika aikaisessa vaiheessa.
. Siellä etsitään tulevaisuuden kassavirtaa ja Faron kokonaisuudessaankin on vähän pieni ja aika aikaisessa vaiheessa.
Uskoisin myös että bexin tapauksessa kun se on uusi kohde ja siinä on vielä paljon tiedettä tehtävänä ja KOL vaikuttamista edessä niin olisi kaikkien kannalta parempi että ostajalla olisi täysi intressi panostaa mahdollisimman paljon sen kehitykseen ja markkinointiin, eli myös koko kohdemarkkinan pitäisi olla heidän eikä vain yksittäisen indikaation verran.
Periaatteessa Faron voisi lisensoida noita pienemmissäkin paloissa, mutta silloin pitäisi saada isoja summia noista upfront maksuina, jotta ne saataisiin rahoitettua ja siinä olisin kyllä osakkeenomistajana vähän kauhuissani että saadaanko kaikki tutkimukset tehtyä omin voimin, se on siis ihan jo operatiivinen haaste. Noilla globaaleilla pharma-yhtiöillä on kuitenkin monella isot tutkimusosastot jotka jurnuttaa kymmeniä globaaleja tutkimuksia vuodessa, joten siinä olisi myös operatiivista hyötyä saatavissa jos saa hyvän partnerin.
Vähän aihetta sivuten jäin eilen miettimään vielä tota rahoitus / partnerointikuviota ja mietin että miksi joku pharma maksaisi nyt faronin kanssa pientä rahaa, kun voi ihan yhtä hyvin odottaa MDS faasi 2 tuloksia ja maksaa sitten paljon isompaa rahaa, mutta huomattavasti varmemmasta lääkkeestä kun on tiedossa että se toimii isommalla joukolla.
Toisin sanoen, sitten kun on 20 potilasta lisää hoidettu ei tunnu niin pahalta maksaa kahta miljardia, kuin kymmenen potilaan perusteella puolta miljardia. (luvut hatusta temmattuja, eivät vastaa mun ajattelua oikeasta hinnoittelusta)
Markku tässä aiemmassa videossa kommentoi juuri tuohon kysymykseen, että Bex lisensoidaan kerralla kaikkiin sovelluksiin. Se varmaan on isossa osassa nyt myös partnerointikeskusteluissa, että sekä kiinteiden kasvainten että verisyöpien kokeita jatketaan samanaikaisesti eteenpäin.
Sen verran tohon Rushimadon kommenttiin että oltaisiin “aikaisessa vaiheessa”…no se on suhteellista kun lääkkeelle haetaan myyntilupaa 2025.
Aikaisessa vaiheessa tässä tapauksessa tarkoittaa, että kokeet esimerkiksi verisyövissä ovat vasta siirtymässä toiseen faasiin. Bexin tehokkuusdata tuskin vielä on riittävää, varsinkin kun Clever-1 itsessään on hyvin epätyypillinen kohdemolekyyli immuno-onkologiassa. Faasin II kokeet on historiallisesti kaikista riskisimpiä, joten isommat firmat mielummin maksanevat lääkeaihioista vasta tehokkuusdatan jälkeen, jos haluavat vähentää omia riskejään. Isoilla lääkefirmoilla on syvät taskut ja nyt markkinoilla on paljon ostettavaa. Voi olla, että Faroniltakin tarvitaan vielä Bexmabin II faasin tuloksia ennenkuin diiliä lyödään lukkoon.
On mukava lukea tätä ryhmää koska täällä on asiantuntevaa porukkaa, kiitos siitä.
Itsellä ei riitä kompetenssi tähän.
Milloin voisi alkaa odottamaan faasi ll tuloksia?
Löytyy tästä Paavon viestistä: Faron Pharmaceuticals - Innovatiivisia lääketieteen ratkaisuja - #3225 käyttäjältä Paavo_Koivisto
Jos ja kun (?) faasit todistavat että Bexmab toimii niin minkälaista liikevaihtoa ja tulosta tällä Bexmabilla on mahdollista tehdä ? Siitä voisi pähkäillä vaikkapa sitä exit hintaa .
Vaikea kysymys, koska bexmab on vain yksi osa Bexin potentiaalia. Lisäksi Faronilla on hematokiini ja Traumakiini. Yhden syöpätyypin kohdalta voi arvioida arvoa yleisyyden, tehon ja keskimääräisen syöpälääkkeen hinnan perusteella. Juhon videolla mainitsema keytrudan vuosimyynti oli huima ja siten Bex:kin onnistuessaan myisi varmaan miljardeja vuodessa. Puhumattakaan jos bexcombo ja monoterapiakin saadaan maaliin. Yksinkertaistettuna…millä hinnalla myydä kultamunia muniva hanhi? Q kakkosen tuloksia odotellessa😁
Varmaan parhaan arvion näistä saa kun lukee tuon Inderesin raportin. Sieltä löytyy arviota myynnistä, verrokkifirmojen arvostuksia, sekä partnerointi- ja M&A diilien dataa.
Syynäsin ASH posteria tarkemmin ja en ollutkaan huomannut erästä asiaa, mikä kyllä oli jonkun pitkän postauksen seassa täällä tullut esiin. Mutta nostan vielä että BEXMABIN MDS- potilaista 4/10 oli pahamaineisia tp53 mutantteja, ja kaikilla menee vielä hyvin. (tosin ei kerrottu oliko bialleelinen mutantti)
Onkohan mielekästä selitystä bexin vaikutusmekanismin kautta tp53 mutanttien käytökselle? Sattumaahan tuo kait todennäkösimmin on, mutta korjaan näkemystäni silti MDS osalta “yhen naksauksen” positiivisempaan.
Vielä kun joku kertoisi miksi AML:ssä ei mene hyvin.
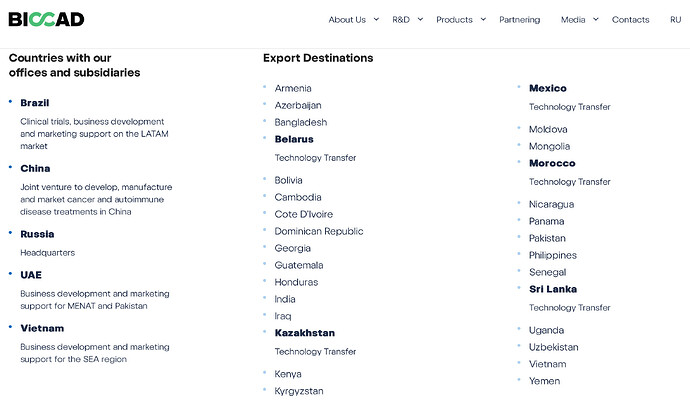
Pembron eli Keytrudan eli laajimman käyttöaihekirjon PD-1-lääkkeen patentin (myös Opdivon) umpeutumisesta reilun 4 vuoden kuluttua on puhuttu. Tarvitsisivat korvaavaa tuotetta/yhdistelmää (BEXCOMBO)/lisäsuojaa jollakin jipolla. Patentin vanhenemiseen liittyen sen biosimilaareja on etenemässä nyt faasi 3:een, osan pitäisi valmistua jo tämän vuoden lopussa. Vertaavat lääkkeitä päittäin ja näin yrittävät päästä markkinalle.
Tarkemmin kun katsoo, yksi on pietarilainen firma…saitit Venäjällä ja markkina-alue kehittyvät maat. Melanoomaan.
Toinen on mAbxience, ilm. argentiinalainen, kohteena ei-pienisoluinen keuhkosyöpä, johon myös BEXCOMBO tähtää. Faasi 3 valmistuu 2025 lopussa.
Kolmas on sveitsiläinen Sandoz, joka kehuu olevansa maailman johtava biosimilaarien kehittäjä. Sandoz irroitettiin big pharma Novartiksesta 3 kk sitten. Globaali jätti jo itsekin. Nyt on helpompi nokkia tuottoja muiden kehittämistä lääkkeistä ![]() . Novartiksella on oma tuoreehko PD-1, spartalitsumabi.
. Novartiksella on oma tuoreehko PD-1, spartalitsumabi.
Sandozin faasi 3 valmistuu 2025 puolivälissä. Melanoomaan sekin. Vasteita melanoomassa nähtiin MATINSissa Bexilläkin, paras näyttö toki vielä puuttuu.
Näissä ilmeisesti on sääntö, että ”The rationale is that if a biosimilar demonstrates equivalent efficacy, safety, and immunogenicity in one FDA-approved indication of the reference product, it can be extrapolated to other indications.”
Varmaa siis on, että paine tulee olemaan kova pembrolle eli Rochelle keksiä jotakin. En tiedä, mikä kehittyvien maiden hinnoittelu pembrossa on ollut. Ja voisivatko köyrätä länteen kehittyvissä maissa halvemmalla tehtyä biosimilaaria. Suomessa esim. melanooman hoitokustannus vastaavalla patentoidulla on 100 k€. Kohta saa ehkä halvemmalla biosimilaareja. Lännessä kai hinta on ainakin puolittunut kopioinnissa yleensä, lääkkeen vanhentuessa lisää voi hinta alkaa jo naurattaakin, muttei valmistajaa.
Tähän jos osaat vastata, niin voit varmaan julkaista tuolla Maijan ja Sirpan kanssa lehdissä ![]()
Veikkkaan, että tätä ei vielä syöpätutkijatkaan osaa tarkalleen sanoa. That being said, seuraava pohdinta on aivan puhdasta spekulaatiota, enkä ota vastuuta sen todenmukaisuudesta.
Iso kysymys mikä Bexin vaikutukseen liittyy hoidettaessa verisyöpiä on se miten paljon tuosta efektistä kohdistuu syöpäsoluihin ja miten paljon syöpää kohdentavaan immuunivasteeseen.
Makrofageilla Bex käsittelyn on näytetty vaikuttavan LXR/RXR ja PPAR signalointireitteihin, jotka mahdollisesti välittävät Bexin efektiä makrofagien fenoptyypppiin (siis immunosupressiivinen tai proinflamatorinen).
" IPA (ingenuity pathway analysis) on the differentially expressed genes between D7 and D0 samples revealed a significant downregulation of the LXR/RXR and PPAR pathways [Fig. 3G], possibly related to the FP-1305–induced impairment in modified LDL scavenging, as shown previously in monocytes cultured ex vivo [30]. At the same time, inflammation-related pathways were activated, as observed by the upregulation of IL1R2, IL1B, JUN , and TNFRSF1A"
Lisäksi Bex blokkaa endosomien asidifikaatiota, joka todennäkösesti lisää antigeenien esittelyä makrofagien pinnalla.
" It has been suggested that reduced lysosomal acidification preserves potential MHC class I–compatible epitopes, thus rescuing antigens from excessive degradation for cross-presentation [31].
…
We detected higher antigen cross-presentation on Clever-1−/− macrophages in all instances, suggesting that the absence of Clever-1 not only elevated macrophages’ ability to cross-present peptide antigen (OVA SIINFEKL peptide) but also directed antigen processing to generate cross-presentable peptides (OVA protein)."
Näiden makrofageihin vaikuttavien mekanismien lisäksi Clever-1:n on esitetty myös omaavan itsessään immunosupressiivisia ominaisuuksia, varsinkin liukoisessa muodossa, jotka haittaavat T-solujen aktivaatiota. Tosin nämä vaikutukset on vielä käsittääkseni huonosti tunnettuja.
https://www.nature.com/articles/s41416-020-0953-0
" We have also demonstrated that human placenta-purified Clever-1 can directly bind both B- and CD8 T cells, and to a lesser extent CD4 T cells from mouse spleen[33] and human peripheral blood.[48] Thus, it is possible that soluble Clever-1 can directly inhibit lymphocyte activation or transmigration by binding a yet unknown ligand on B- and CD8 T cells, and does not need immunosuppressive support from the type 2 macrophage. In fact, Clever-1 can be found as a soluble form in human blood and lymph where it could possibly interact with lymphocytes to regulate their functions.[48]"
Mitkä näistä efekteistä sitten voisivat vaikuttaa P53:n kautta? Oma veikkaukseni on, että todennäköisesti suurempi vaikutus tulee olemaan immuunivasteen säätelyn kautta kuin suoraan syöpäsoluihin (perustuen ei juuri mihinkään, koska veikkaus). P53 on tärkeä faktori, joka välittää DNA vaurioiden ja korjauksen vaikutusta solujen jakautumiseen ja säädeltyyn solukuolemaan. (ylim. huom. TP53 on geenin nimi ja P53 on sen tuottama proteiini. Nämä on tässä tekstissä aika sekaisin viljeltynä)
Ensimmäinen veikkaus voisi olla, että TP53 mutantti soluissa voisi olla enemmän muita mutaatioita, jotka voisivat muodostaa esimerkiksi immuunisoluille tunnistettavia syöpäantigeenejä. Alustavan googlailun perusteella kuitenkin vaikuttaisi siltä, että esimerkiksi DNA korjaukseen liityvät mutaatiot korreloisivat paremmin immuunivasteen kanssa ja TP53 mutaatiot olisivat paljon kontekstiriippuvaisempia. The interaction of p53 and DNA repair gene mutations and their impact on tumor mutation burden and immune response in human malignancies - PMC
Toinen veikkauksen olisi, että tuo efekti voisi liityä muihin syöpäspesifeihin antigeeneihin, kuten endogeenisistä retorviruksista (ERV) johdettuihin antigeeneihin. ERV:t eivät normaalisti ilmene erilaistuneissa soluissa, joten niiden ilmeneminen muodostaa hyviä antigeenejä immuunisoluille tunnistettaviksi. Hypometyloivilla lääkeaineilla voidaan aktivoida ERV:ien ilmenemistä ja TP53 mutaatioiden on näytetty vähentävän ERV:ien aktivaatiota.
https://www.nature.com/articles/s41392-023-01626-x
" Interestingly, in TP53 mut patients, in addition to activated pathways involved in TP53 -targeted biological functions such as positive regulation of cell cycle and negative regulation of intrinsic apoptosis (Supplementary Fig. 2a), multiple viral regulation pathways (regulation of viral genome replication, response to virus, and defense response to virus) were shown to be repressed, accompanied by the inhibition of immune modulation (response to IFN-gamma, response to type I IFN, and T cell activation), as revealed by gene set enrichment analysis (GSEA)
…
Among the main virus genera detected, only ERVs were remarkably down-regulated in TP53 mut DLBCL"
Lisäksi
" 5-Aza-2’-deoxycytidine (decitabine) is a hypomethylating agent that exhibits anti-tumor activity by reactivating tumor suppressor genes.15 In myelodysplastic syndrome (MDS) and acute myeloid leukemia (AML), the outcome of TP53 mut patients is significantly improved by decitabine treatment.16,17"
Eli mitä tästä kaikesta nyt saadaan lopputulemana? Oma veikkaukseni on, että tuo TP53 mut responssi riippuu lähtökohtaisesti tuosta hoidossa käytettävästä AZA:sta ja siitä miten AZA aktivoi ERV sekvenssejä ja saa aikaan syöpäspesifien antigeenien ilmenemisen. Ongelmana lienee se, että MDS ja AML syöpäsolut ilmentävät paljon myös Clever-1:stä pinnallaan (ja liukoisena), joka hiljentää T-solujen aktivaatiota. Eli, vaikka AZA itsessään saisi aikaan T-soluresponssin syöpäkohtaisia antigeenejä vastaan, se ei pääse aktivoitumaan kunnolla johtuen korkeasta Clever-1 määrästä ja Clever-1:n immunosupressiivisesta roolista. Ongelmana tässä on se, että tuota Clever-1:n immunosupressiivista rolia ei tunneta vielä kunnolla.
TL;DR En tiedä. Pitäsi varmaan kysyä fiksummilta.
Niille, jotka eivät ole ihan inessä tässä skenessä kerrottakoon, että tumour protein 53, TP53-mutaatio on geneettinen muutos, joka vaikuttaa solujen kykyyn korjata DNA-vaurioita ja estää syöpäsolujen kasvua. Normaalisti toimiva proteiini p53 on jarru solunjakautumiselle. Jos jarru ei enää toimi, syöpä saa vallan. TP53 ei liity vain verisyöpiin, vaan myös kiinteisiin.
Joulukuun BEXMAB-päivityksessä ”The majority of higher-risk MDS patients were also TP53 mutated, typically associated with poor responsiveness to standard therapy, however all of them achieved CR/mCR upon receiving the treatment”.
TP53-mutaatiota on noissa higher-risk tapauksista eri lähteiden mukaan 40 % tutkimuksessa, jossa aza käytössä
Tai 37 %
Tai 40 %:
”Notably, TP53 mutations, with an overall incidence of about 10% in de novo MDS and 40% in therapy-related MDS (t-MDS patients) [12,13], is independently associated with resistance to conventional therapies, rapid transformation to AML, and a poor outcome [14]. Of note, in MDS cases with five or more karyotype abnormalities, the absence of TP53 mutations is associated with a much better survival compared to those with TP53 mutations [15].”
Miksi BEXMABissa suurimmalla osalla olisi TP53 johtunee siitä, että mahdottomana pidettyä tautityyppiä halutaan tarjota tutkimukseen, jos ihmeitä tapahtuisi tai sitten se liittyy tuohon azan valintaan eli potilaat valikoituvat jo ennen tutkimusta. Tai sitten pienen potilasmäärän vuoksi on tosiaan sattumaa. Tai vain se, että BEXMABiin valitaan higher-risk ja TP53 on lähes sama kuin higher-risk.
KOLCall puhutaan TP53 kohdasta 12:50, Naval puhuu tosin paljon TP53 AML:stä.
Samoin kohta 37:40, jossa Naval kertoo magrolimabin trialiasta, joka on erityisesti TP53 potilaisiin (meni puihin myöhemmin😀)
Jopa kantasolusiirron jälkeen TP53 survival on huono, mutta sitä voitaisiin parantaa ennen ja/tai jälkeen siirron lääkityksellä (Bex?).
TP53-mutaatioita on tosiaan useasti kiinteissäkin syövissä. En löytänyt Faronin tutkimuksista, että sen ilmenemistä niissä olisi linkattu vasteisiin tai sitä edes pohdittu ja minullakaan ei ole alumiinifoliota niin paljon, että siitä hattua saisi.
TL;DR
Bex toimii omilla @jerej kertaamilla vaikutusmekanismeillaan ja mikä tärkeintä, TP53-mutaatiosta huolimatta, joten Bexin vaikutusmekanismille ei noilla proteiineilla ole merkitystä.
Ja voi hyvin olla, että tuo mahdollinen Bexin teho TP53 mutanttisyöpiä vastaa riipuu juuri siitä, että Bex ei mekanistisesti liity TP53:een. Esimerkiksi monet sytostaattihoidot perustuvat solunjakautumisen estämiseen tuottamalla DNA vaurioita. Tässä prosessissa P53:lla on keskeinen säätelytehtävä. Immuunihoidoissa on hyvin erilaiset eri mekanismit, joten TP53 mutaatiot eivät ehkä vaikuta samassa määrin niihin.
Uskon kuitenki, että Bexin teho pohjimmiltaan, myös verisyövissä, johtuu immuunivasteen aktivaatiosta, tai siis tarkemmin Clever-1 välitteisen immuunisupression estämisestä. Tämä on huonosti tunnettu alue, joten tähän liittyy sekä Faronin riskit että mahdollisuudet.
Marie-Louisesta (ex CMO, nyk. hallituksen jäsen) on näkynyt häivähdys postauksena. Faron: ”Productive trip”.
Yrjö Wichmann (VP funding&IR) Faronista postasi kuvan, jossa itse J.P. ja meidän Markku. Eturivin paikoista tuli niin kova tappelu, että lopulta ne piti jättää tyhjiksi. /s
Talking talking not shooting (vai kuis se hyvät, pahat ja rumat menikään)
Tossa on Ylen juttu niistä car-t hoidoista minkä haittavaikutuksiin traumakineä sorvataan. Hyvä kansantajuinen juttu jos se on täysin tuntematon alue.
Tammikuun corporate deck on julkaistu. Siinä on JPMorganin slidet nyt helposti saatavina.
Vielä JPMorganista:
Markku vastaa kysymykseen, jossa todetaan, että makrofageihin vaikuttaminen on osoittautunut vaikeaksi, mikä erottaa Bexin muista? Markku sanoo, että häneltä usein kysytään, tekeekö Bex saman kuin anti-CD47 (kuten magrolimabi)? Ei ollenkaan, hän vastaa (ja ottaa hajurakoa), Bex aktivoi makrofagit (ja suuntaa immunostimulatoriseen M1-tilaan), CD47:t vain blokkaa vastinreseptorin. Etäisyyden otto ehkä perustui magrolimabiin yhdistettäviin epäonnistumisiin?
On näytetty nykyajan menetelmin (viittaa tässä MATINS-tutkimuksen ennen ja jälkeen Bexin tehtyihin transskriptomi- eli geenien luenta-analyysiin), että Bex aktivoi syöpäkudoksessa 20-30 komponenttia, samat kuin lipopolysakkaridilla (LPS) stimuloiden tapahtuisi (LPS on bakteerin soluseinämän osa, jota vastaan synnynnäinen immuniteetti on ohjelmoitu toimimaan meillä kaikilla). Tämän Bexin stimulaation jälkeen kudokseen tulee uusi setti t-soluja, jotka hyökkäävät syöpää vastaan.
Markku jo konffan alussa Faronin esittelyssä kertoi uskovansa: ”I believe we are the world leader in reprogramming myeloid cells.” Tämä voi olla tottakin.
Huutokauppaprosessista Inden haastattelusta kuultuna ihmeteltiin vähän aikaa sitten, eikö siitä pitäisi virallisesti tiedottaa. Nyt tuli ”Outlook for the next 12 months”- kalvolle, että yhtiön osalta outlook on ”Proceed with partnering discussions to auction process”. Prosessi on alkanut, mutta varsinainen huutaminen ei varmaankaan. Data roomia ei mainittu.