Xbranen myyntilupa Xlucanelle Eurooppaan varmistui odotetusti, samalla Stada muuttaa lääkkeen brändinimen “Ximluci” -nimiseksi.
"European Medicines Agency’s CHMP adopts positive opinion for Ximluci® biosimilar candidate referencing Lucentis® (ranibizumab). Positive opinion proposes authorization of Ximluci® throughout EU. STADA CEO Peter Goldschmidt: “This positive opinion reflects STADA’s ongoing expansion of its biosimilars portfolio within Specialty Care, as well STADA Specialty Care’s entry into a new therapeutic category – ophthalmology. “**
Bad Vilbel; Stockholm – 16 September 2022 – Partners STADA Arzneimittel AG ("STADA”) and Xbrane Biopharma AB (publ) (“Xbrane”) (Nasdaq Stockholm: XBRANE) announce that the European Medicines Agency’s (EMA’s) Committee for Medicinal Products for Human Use (CHMP) has adopted a positive opinion for Ximluci®, a biosimilar candidate referencing Lucentis® (ranibizumab).
Ranibizumab is an anti-VEGF (vascular endothelial growth factor) for the treatment of retinal vascular disorders, which are a leading cause of blindness. Ximluci has been recommended for approval in the European Union (EU) for the treatment of wet age-related macular degeneration (AMD), diabetic macular oedema (DME), diabetic retinopathy (PDR), retinal vein occlusion (RVO) and visual impairment due to choroidal neovascularization (CNV).
The CHMP’s positive opinion will now be referred to the European Commission (EC), which will decide whether to grant a marketing authorization based on the CHMP’s opinion. Provided the EC grants a centralized marketing authorization valid in all 27 European Union member states, as well as in Iceland, Norway and Liechtenstein, commercial launches by STADA will follow upon receipt of local clearances.
“This positive opinion reflects STADA’s ongoing expansion of its biosimilars portfolio within Specialty Care, as well as STADA Specialty Care’s entry into a new therapeutic category –
ophthalmology,” commented STADA CEO Peter Goldschmidt. “We look forward to continuing in our mission to expand patient access to biological treatments through this strategic partnership with Xbrane.”
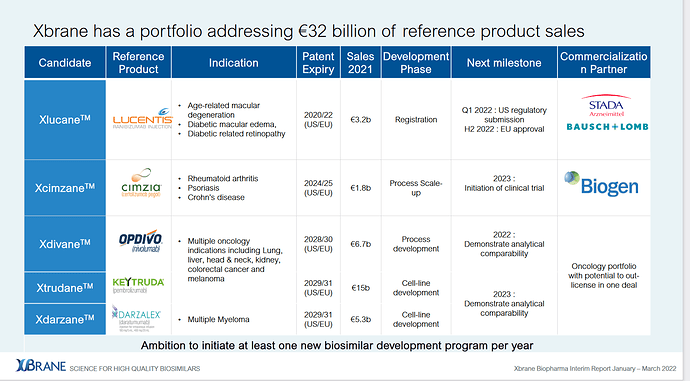
If approved, ranibizumab will also be the sixth product approved within STADA´s biosimilar portfolio, joining adalimumab, bevacizumab, epoetin zeta, pegfilgrastim and teriparatide.
Furthermore, if approved, Ximluci – which was developed under the XlucaneTM name – will be the first biosimilar candidate authorized through the partnership between Xbrane and STADA, and the first biosimilar Xbrane has taken all the way from cell-line development to approval.
“The positive opinion of the CHMP is a great milestone for Xbrane as it paves the way for approval of our first biosimilar candidate in Europe. We are pleased to be able to make available a more affordable treatment option for patients suffering from these severe eye diseases,” stated Martin Åmark, CEO of Xbrane.
The positive CHMP opinion for Ximluci was based on a comprehensive comparative analytical assessment and a Phase 3 clinical study that demonstrated equivalent efficacy and comparable safety to the reference product Lucentis. The Phase 3 clinical study involved 580 patients with wet age-related macular degeneration. The primary endpoint of the study was the change in best corrected visual acuity (BCVA) at week 8 compared to the baseline. This was met, as the adjusted treatment differences between the two products were within the predefined equivalence margin.
In July 2018, STADA and Xbrane entered into an agreement under which the two companies are jointly responsible for development until regulatory approval and for manufacturing the finished product. STADA will hold the marketing authorizations and the commercial rights to the biosimilar across all territories included in the agreement, which covers Europe, the US, several countries in the Middle East and North Africa (MENA) region, and several Asia-Pacific (APAC) markets.
STADA is also a long-term committed shareholder in Xbrane, having supported the company in several financing rounds. In connection with this, the companies also have entered into a Strategic Biosimilar Development Partnership under which STADA has been granted a right of first refusal on several biosimilar candidates in Xbrane’s portfolio.
The market for anti-VEGFs for the treatment of retinal disorders in Europe generated sales of approximately €4 billion in 2021 and grew by 8% per year on average between 2019 and 2021."
Kurssikin palautunut alkukesän sekoiluista takaisin tasoille, joissa oikeastaan pyörinyt koko vuoden.
Xbrane järjestää 22.9 Capital Markets Dayn, jossa myös Stada mukana todennäköisesti esittelee myyntisuunnitelmiaan. Kertauksena mainittakoon, että Stada ja Xbrane jakavat lääkkeen myyntitulot 50/50, eli liikevaihdosta vähennetään tuotanto- ja myyntikulut, minkä jälkeen tulot jaetaan.