Foorumilla on ollut paljon keskustelua Gileadista & Forty Sevenistä. Alla mielenkiintoinen tiedote liittyen aiheeseen.
Vaiko syy Gileadille alkaa etsimään vaihotehtoisiä lääkkeitä anti-CD47 vasta-aineiden tilalle tai oheen kombinaatioksi? En tiedä olenko tarpeettoman härkäinen tämän keissin suhteen, mutta ennemmin näen tämän isommille firmoille syynä alkaa kohta kilpailemaan siitä kuka saa ostaa Faronin markkinoilta. Magrolimabin ja Bexin toimintamekanismit ovat kuitenkin hyvin erilaiset ja siinä missä anti-CD47 saattaa epäonnistua voi anti-Clever-1 hyvinkin toimia.
Eikös tuo Magrolimab ollut noissa kokeissa ensimmäisenä hoitona, ja Bexiä taas testataan niillä joilla mikään ei ole toiminut?
Ei kyllä kuumottele yhtään, päinvastoin.
Faronilla on erinomaiset tulokset juuri MDS:stä. Siitä voi spekuloida, mitä siitä seuraa…
Levitetään tässä Lontoon porukan löytöjä Clinical Trial Arenasta:
Aiemman Gilead jutun lisäksi siellä:
Bexmab - uusia saitteja
United States, Texas
The University of Texas Health Science Center at San Antonio
San Antonio, Texas, United States, 78229-3901
Finland
Clinical Research Institute HUCH Ltd
Helsinki, Finland, 00290
Oulu University Hospital
Oulu, Finland, 90220
Tampere University Hospital
Tampere, Finland, 33520
Turku University Hospital
Turku, Finland, 20520
France
The Institut Gustave Roussy
Villejuif, France, 94805
Netherlands
Erasmus University Medical Center Rotterdam
Rotterdam, Netherlands, 3015 GD
Spain
START Madrid - CIOCC Hospital HM Sanchinarro
Madrid, Spain, 28050
United Kingdom
The Royal Marsden NHS Foundation Trust
Sutton, Surrey, United Kingdom, SM2 5PT
Queen Elizabeth Hospital Birmingham
Birmingham, United Kingdom, B15 2GW
The Christie NHS Foundation Trust
Manchester, United Kingdom, M20 4BX
Tuo Clinical Trialsin linkki on Matinsin kokeisiin. Bexambin numero on tämä NCT05428969. Tuohon ei ole ainakaan vielä merkitty uusia saitteja Bexmabiin Suomen saittien ja Teksasin ja Kalifornian saittien lisäksi.
Jouduin etsimään tiedon mikä on Matins ja miten se eroaa AML/MDS suhteen:
MATINS (Macrophage Antibody To INhibit immune Suppression) trial is a
three-part, first-in-human phase I/II study (NCT03733990) to assess the safety and
preliminary efficacy of FP-1305 in patients with advanced solid tumours.
Eli ainakin erona on se että Matins on aikaisempi trial ja kiinteille syöville?
Tässä on aiempi kommenttini alkuvuodelta, jossa kävin lyhyesti läpi mitä mikäkin nykyinen koe käsittelee.
Näitä kokeita on nyt siis jäljellä kolme, Matins, Bexmab ja Bexcombo. Matins ja Bexcombo on kiinteiden kasvainten hoitoon tähtääviä ja Bexmab myeloidilinjan verisyöpiin.
No kah, näin onkin. Puusilmä efekti iski kun googletin.
Matinsia on päivitetty viimeksi 3.7.2023, tila on nyt active, not recruiting. 216 potilasta kaikkiaan.
Viimeisin tilatieto:
[June 29, 2023]
(Recruitment Status, Study Status, Contacts/Locations and Study Design
Uudet nettisivut.
Jos ennen nettisivut oli 2/5, niin voi sanoa että nyt ne on 5/5.Hyvää pöhinää nyt.
Proactiven sivuilla on julkastu lyhyt video joll Faronon CMO Fjällskog avaa viimeisimpiä tuloksia. Suurin osa on jo pureskeltu tässä ketjussa. Ainakin itselleni oli uutta tietoa tämä 13 kk potilas mikä mielestäni tukee BEXin hyvää siedettävyyttä
Videon tiivistelmä Proactiven sivuilta:
”Chief Medical Officer Marie-Louise Fjällskog speaks to Thomas Warner from Proactive after releasing an update on progress with the clinical stage biopharmaceutical company’s phase I/II BEXMAB study.
Fjällskog gives an overview of the update, highlighting several “very nice objective responses” to Bexmarilimab treatment and saying that the data “just confirms that we have some very exciting things going on with our combination.” One patient has now stayed on the treatment for 13 months, the company noted in its update.
Looking further down the line, Faron said that it expects to file the first Biologics License Application (BLA) to US Food and Drug Administration (FDA) planned by the first half of 2025.
Fjällskog also mentions that the company is currently active in recruiting more patients for its study and is opening more sites in the US and potentially in Europe to aid with the effort.
Bexmarilimab, a novel anti-Clever-1 humanised antibody, is Faron’s investigative precision immunotherapy with the potential to provide permanent immune stimulation for difficult-to-treat cancers through targeting myeloid function.”
Muutamia huomioita
Tuo 13 kk mukana ollut on siinä mielessä positiivinen myös, että Bexia annetaan niin kauan kuin potilas saa vastetta eli myyntiä tulee sitten oikeassa elämässä sitä enemmän, mitä kauemmin Bex toimii. Hänkin on ”parantunut” luuytimen ja veriarvojen osalta uusiutuneesta leukemiasta, aika näyttää kuinka pysyvä tulos on.
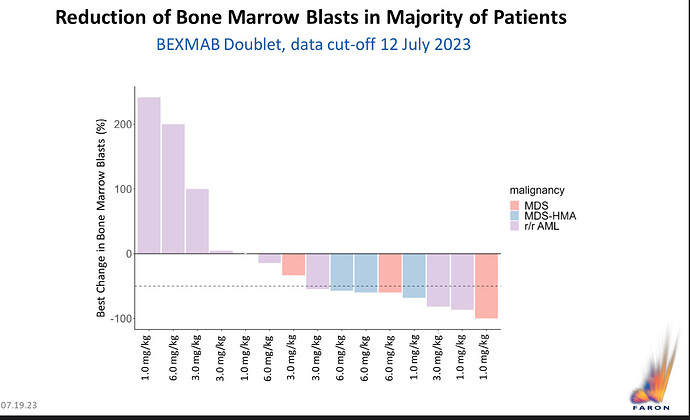
Jatkossa kannattaa seurata r/r AML eli aiemmassa hoidossa epäonnistuneet/uusineet myelooiset leukemiat ja MDS-HMA:t eli esim. Azaa jo aiemmin saaneiden vastaavat. MDS on luuytimen kantasolujen sairaus, ”esisyöpä”, joka johtaa tehottomaan verisolujen muodostumiseen, koska luuytimen kantasolut eivät kypsy ja erilaistu verisoluiksi normaalisti. Tuo yllä oleva ML:n video on osin munkkilatinaliturgiaa, jota tosifanit voivat kyllä sujuvasti kuunnella messunakin, mutta kun hän puhuu ”blasts”, tarkoittaa hän luuydinnäytteestä löydettyjä kypsymättömiä soluja, joista olisi pitänyt tulla kolmea eri verisolulinjaa; punasoluja ”red cells”, valkosoluja ”white cells” ja verihiutaleita ”platelets”, yhdessä nuo kolme ovat veriarvot eli ”blood cell count”.
Vasteet slideissa hoidolle ovat:
SD eli stable disease, jolloin tauti pysyy aisoissa, ei selvästi parane ei pahene
PD eli progressive disease, tauti pahenee eli blastien määrä nousee johtaen veriarvojen huononemiseen ja tod näk kuolemaan TAI sitten potilas siirtyy toiseen kokeelliseen trialiin
CR on täydellinen vaste, blastit pudonneet matalalle tasolle luuytimessä ja em. kolme solulinjaa normalisoituneet veressä
CRi sama kuin ed. mutta kaikki verisolulinjat eivät ole normalisoituneet
Allo-HSCT on kantasolusiirto, onnistuminen Bexin kannalta sekin, jos potilas saatiin sillä sellaiseen kuntoon, että siirto onnistuu
mCR on luuytimen blastien täydellinen vaste, verisolut eivät ole normalisoituneet
50 % blastien vähentyminen, ei sovi mihinkään em. luokituksessa, seuraava mittaus näyttää kumpaan suuntaan kääntyy
HI-P on Hematologic improvement-platelets eli verihiutaleiden määrän normalisoituminen
Käännettynä esim. Google translatella:
Kahdeksan 15 OR:sta havaittiin kaikissa kolmessa kaksoisannoskohortissa.
Tässä Faron tarkoitti ilmeisesti viestiä, että vastetta tuli kahdeksalle potilaalle 15 potilaasta ja kaikilla eri annoksilla. Kysymys siitä, missä ne loput 7 OR:ää ovat on turha, koska niitä ei ollut. Lääketieteen kielessä ”Eight of 15 ORs” tarkoittaakin vastetta 53 %:lla potilaista. Sähkösanomatyyli on vaikea ja väärinymmärrys helppoa aina, kun voi ymmärtää väärin🙃
Faron viesti 2023-07-19 09:01:00 Conference Call ”Following the completion of the event, a replay will be available on the Company’s website.”
On siellä slidet https://www.faron.com/sites/faron-corp/files/faron/investor/results/BEXMAB%20Study%20Update%20Deck%20July%2019%202023.pdf, mutta callin replayta ei @Paavo_Koivisto
Nyt osa sijoittajista on saanut esim. Q&A infon (mm. ML kertoi tavoitteista) ja osa ei.
Oliko toi mCR hyvä vai huono juttu?
Valitettavasti maksumuurin takana, mutta Markku toteaa artikkelin lopussa, että syksyn testitulosten jälkeen ensi keväällä siirtyvät pivotaalivaiheeseen (nopeutetussa lupamenettelyssä kind of faasi3) ja että “lupahakemuksen maksimikäsittelyaika on 150 päivää, jonka aikana FDA voi esittää lisäkysymyksiä. Jos lupa myönnetään, markkinointi voi alkaa seuraavana päivänä.”
Kyllä se on hyvä juttu. Kun nuo blastisolut eli epäkypsät verisolujen esivaiheet on saatu taklattua, luuydin voi alkaa toipua ja muodostaa verenkiertoon kypsiä puna- ja valkosoluja ja verihiutaleita. Niiden määrät riippuvat niiden eliniästä eli uusien tulosta ja vanhojen poistumasta. Punasolut elävät 2-3 kk, eri valkosolut päivistä useisiin viikkoihin ja verihiutaleet reilun viikon. Näin ollen voi olla ihan toivottava prosessi, että ensin korjaantuu tehdas eli luuydin ja sitten vasta tuotteet eli verisolut. Jälleen, aika eli pari kk näyttää mihin päädytään. Pelkkä luuytimen toipuminen ei ole toipuminen eli tehdas ilman tuotteita on hyödytön. Punasolujen puute aiheuttaa hapenpuutetta ja jatkuvaa luovuttajaveren tankkausta, josta rautakuormitus, valkosolujen puute infektioriskit, johon ehkä väliaikaista apua valkosolukasvutekijäpiikeistä ja verihiutaleiden vajaus verenvuotoriskejä, vaikeimmillaan joudutaan niitäkin luovutusverestä tankkaamaan ja siitä hetken apu.
Aloitusraportin tuottolaskelmien mukaan MDS:ää sairastavista saisi Bexia vain 10 %. Nyt standardihoito eli Aza tehoaa aluksikin vain n. 50 %:lle. Lopuiltakin teho häviää useimmiten vähitellen. Veikkaisin, että Bexia tulee saamaan lopulta lähempänä 100 % kuin 10 % potilaista.
Ainoa parantava hoito on kantasolusiirto, mutta sen hoidon sivuvaikutuksiin kuolee noin 25 %. Siirron jälkeenkin tauti voi uusiutua, 15-30 %:ssa. Siirron saamiseksi lasketaan riskipisteet, joissa blastien määrän ja verisolulinjojen kunnon mukaan annetaan pisteitä. Jos ja kun Bexin annon jälkeen on saatu potilas Suomessakin siirtokuntoon, avaa se isommmat markkinat. Paremmilla veriarvoilla ja luuytimen kunnolla tulee vähemmän esim. vaarallisia infektioita siirron yhteydessä ja onnistumisprosentti nousee.
Faasi 3/pivotal toki ratkaisee lopullisesti tehoasian, miljardien dollarien magrolimabikin oli tehoton faasi 3:ssa, vaikka 1b:ssä näytti yhdistelmähoitona tehoa 91 %:ssa. Magroa annettiin 3:ssa sokkona joko Azan kanssa tai pelkkä Aza. Kyseessä oli tuoreet aiemmin hoitamattomat MDS:t. Faasi 1b:ssä samoin oli kyse ensilinjan hoidosta Azan kanssa.
Jos Bex jatkaa näyttöjä Aza-hoidossa epäonnistuneissa tapauksissa (MDS-HMA) faasi 2:ssa, epäonnistumisen riski 3:ssa on pienempi kuin magrolla. Kuumeisesti varmaan etsitään yhteisiä markkereita r/r AML-potilaille, joille Bex ei toiminut. JOS löytyy, päästään rikastamaan aineisto ja tulokset ![]()
Inderesin arvio rahoitustarpeesta, perustuen Faronin presikseen, oli aloitusraportissa faasi 2 ja 3 tutkimusten saamisesta päätökseen 50+100 miljoonaa. Tämän pääomainjektion mahdollinen, ei enää täysin villi, skenaario on BMS:n eli VIDAZA® (azacitidine) – Bristol-Myers Squibb Companyn upfront maksu 200M USD, jolla saadaan MATINS, BEXMAB ja BEXCOMBO tehtyä loppuun ja siksi ajaksi käyttöpääoma firmalle.